Különös módon az intelligens tervezés hívei ritkán (esetleg
soha sem?) hozakodnak elő immunológiai példákkal hitük igazolására, pedig az
immunrendszerben is történnek ám csuda dolgok. Aki már rakott be véletlenül
elemet fordítva a helyére, tudja, hogy érdemes emlékezni a polaritásra. De ki
gondolta volna, hogy erre immunsejtjeink is képesek?
Immunrendszerünk T és B sejtjei (limfociták) nagy
specificitással képesek kórokozók fehérjéit felismerni és a szervezetből eltávolítani.
A limfociták az egyszer látott fehérjéket megjegyzik, így egy következő
alkalommal sokkal gyorsabban és hatékonyabban képesek reagálni. A jelenség neve
immunológiai memória, ezen alapul a csecsemők rutinszerü immunizálása (pl.
kanyaró vagy rubeola ellen), ami élethosszig tartó védelmet biztosít.
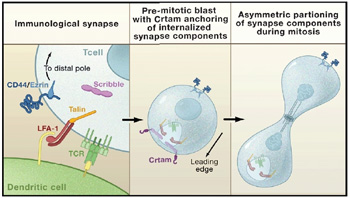
A kórokozókból (baktérium, vírus) származó fehérjéket (antigének)
speciális ún. antigén-prezentáló sejtek (pl. dendritikus sejtek) mutatják be a
T sejtek számára. Az antigén felismerés több membránfehérje koordinált kölcsönhatása
által kialakított immunológiai szinapszisban történik. Az ily módon aktiválódott
T sejtek egyrészt osztódással nagy számú, magukhoz hasonló specificitású effektor
T sejtet hoznak létre, amelyek rövid életüek és képesek hatékonyan elpusztítani
a kórokozót. Ugyanakkor hosszú életü memória T sejtek is keletkeznek, amik az
éveken át tartó védelmet biztosítják.
A memória kialakulása az immunológia egyik izgalmas kérdése.
Elméletileg ugyanis többféle variáció is elképzelhető: az effektor T sejtek egy
része osztódással memória T sejteket hozhat létre vagy egy bevégzett
immunválasz után fennmaradó effektor T sejtek tovább differenciálódhatnak
memória T sejtekké. Mintegy egy éve a Science-ben publikált cikk ezekkel
szemben azt a teóriát erősíti, miszerint az effektor és memória sejtek a T sejt
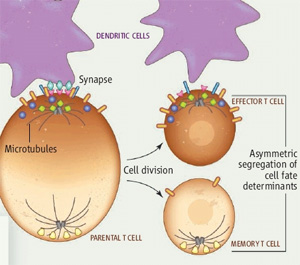
aktivációt követő egyenlőtlen (aszimetrikus) sejtosztódással alakulnak ki. Az
elmélet szerint az osztódás menetét a membránfehérjék T sejt aktiváció alatti aszimetrikus
eloszlása miatt kialakuló polaritás határozza meg: az immunológiai szinapszis
oldalán létrejövő utódsejtből effektor sejt lesz, az ellenkező oldalán pedig
memória T sejt. A kísérletekben a kutatók olyan T sejteket használtak, amelyek csupán
egy baktériumot (Listeria monocytogenes) ismernek fel. A sejteket festékkel töltötték
fel, majd Listeria-val fertőzött egerekbe injektálták. Ha egy ilyen jelölt sejt
osztódik, a festék az utódsejtekben a felére hígul. Ily módon pontosan
követhető, hogy a beinjektált populáció hányszor osztódott. Az egyik, az immunológiai
szinapszis kialakításában szerepet játszó molekula, a CD8. A csupán egyszer
osztódott sejtek között két alpopulációt találtak: egy CD8-t magasan és
alacsonyan expresszálót. A CD8 magas T sejtek egyéb tulajdonságaik alapján
inkább effektor T sejtekre emlékeztettek, míg a CD8 alacsony populáció memória
T sejtekre. Funkcionális bizonyíték gyanánt megmutatták, hogy izolált CD8 magas
illetve CD8 alacsony T sejt populációkat újból egerekbe injektálva csak a CD8
alacsony populáció volt képes hosszantartó védelmet biztosítani Listeria
fertőzés ellen. Ezen eredmények azt az elméletet erősítik, miszerint az
effektor- és memória T sejtek egyidőben, aszimetrikus osztódással jönnek létre.
Egy bökkenő azért van a dologban: a valóságban a T sejt és az
antigén-prezentáló sejt kapcsolata általában hamarabb megszakad, mielőtt az
első T sejtosztódás bekövetkezne (ami akár 2 nappal később történik). Hogyan
emlékszik akkor mégis a T sejt az aktiváció során kialakult polaritásra? A
problémára frappáns megoldást kínál egy új, a Cell-ben nemrég megjelent cikk. Eszerint
a polaritást hordozó információ megőrzéséért a Crtam és Scribble nevü fehérjék
felelnek. Az immunológiai szinapszis felbomlása után, az abban résztvevő
molekulák a sejten belül, speciális kompartmentekbe kerülnek és ott tárolódnak.
Crtam és Scribble, amellett, hogy megvédi ezeket a kompartmenteket a
lebomlástól, gondoskodik arról, hogy a későbbi aszimetrikus osztódás során ezek
a molekulák specifikusan csak az egyik utódsejtbe kerüljenek. Így, bár az
aszimetrikus osztódás térben is időben is távol történik a T sejt aktivációtól,
az eszes T sejt mégis emlékszik az ott és akkor kialakult polaritásra.
Az aszimetrikus sejtosztódás kritikus folyamat bármely
többsejtü élőlény fejlődése során, valamint a felnőtt egyed őssejtjeinek
fenntartásában, ezért a folyamat tanulmányozása eddig főként a
fejlődésbiológusok terepe volt. Egyenlőre úgy tünik, hogy a fontosabb molekuláris
szereplők a T sejtek esetében is ugyanazok. Itt az ideje azonban hogy az
immunológusok is beleássák magukat a részletekbe, hiszen jól tudjuk ki lakozik
ott.
J.T.Chang et al. (2007) Asymmetric T
Lymphocyte Division in the Initiation of Adaptive Immune Responses. Science 23 March 2007: 1687-1691.
Yeh JH, Sidhu SS, Chan AC. (2008)
Regulation of a late phase of T cell polarity and effector functions by Crtam. Cell Mar 7;132(5):846-59

 Ma is arra szeretnék egy példát mutatni, hogy a természetben mi minden kerülhet be egy élőlény genomjába csak úgy. Régebben már írtam olyan élősködő
Ma is arra szeretnék egy példát mutatni, hogy a természetben mi minden kerülhet be egy élőlény genomjába csak úgy. Régebben már írtam olyan élősködő  A GMO vitában a Monsanto ekézése és a toxin illetve méreg szavak ütemes ismételgetése mellett rendre elsikkadnak azok a találmányok, amik annyira újszerűek, hogy egész iparágakat válthatnának ki, ha egyszer végre engednék őket termeszteni. Ma egy ilyenről lesz szó.
A GMO vitában a Monsanto ekézése és a toxin illetve méreg szavak ütemes ismételgetése mellett rendre elsikkadnak azok a találmányok, amik annyira újszerűek, hogy egész iparágakat válthatnának ki, ha egyszer végre engednék őket termeszteni. Ma egy ilyenről lesz szó. A jellegzetes végtagveszteséggel és az arc torzulásával járó betegség már az ókori Egyiptomban is szedte áldozatait, Európába első ízben Nagy Sándor “telepítette be” indiai hadjáratából visszatérve. Az ókorban és a középkorban örökletes betegségnek, átoknak vagy éppen büntetésnek vélték, a leprajárványok kezelése ennek megfelelően a különösen hatékony elkülönítés és megbélyegzés volt [2]. Aki azonban azt gondolná, hogy a lepra a letűnt idők betegsége, igencsak téved. A betegséget okozó, a tuberkulózis kórokozójával rokon baktériumokat 1873-ban fedezte fel Hansen, ám kezelésképpen még vagy hatvan évig legfeljebb a bőrolajfa (Hydnocarpus kurzii) olaját fecskendezték több-kevesebb sikerrel a leprás betegek bőre alá. 1950 óta alkalmazzák a dapszon nevű antibiotikumot a lepra terjedésének megállítására (nem sokkal később jelentek meg a dapszon-rezisztens Mycobacteriumok [3]), és 1990 óta 14 millió leprás beteget kezeltek világszerte. A betegség ellen folytatott ádáz küzdelemnek és a többféle antibiotikumból (dapszon, rifampicin és clofazimin) álló terápiának köszönhetően 2011-ben már “csak” közel 200 ezer új leprás fertőzést regisztrált a WHO [2].
A jellegzetes végtagveszteséggel és az arc torzulásával járó betegség már az ókori Egyiptomban is szedte áldozatait, Európába első ízben Nagy Sándor “telepítette be” indiai hadjáratából visszatérve. Az ókorban és a középkorban örökletes betegségnek, átoknak vagy éppen büntetésnek vélték, a leprajárványok kezelése ennek megfelelően a különösen hatékony elkülönítés és megbélyegzés volt [2]. Aki azonban azt gondolná, hogy a lepra a letűnt idők betegsége, igencsak téved. A betegséget okozó, a tuberkulózis kórokozójával rokon baktériumokat 1873-ban fedezte fel Hansen, ám kezelésképpen még vagy hatvan évig legfeljebb a bőrolajfa (Hydnocarpus kurzii) olaját fecskendezték több-kevesebb sikerrel a leprás betegek bőre alá. 1950 óta alkalmazzák a dapszon nevű antibiotikumot a lepra terjedésének megállítására (nem sokkal később jelentek meg a dapszon-rezisztens Mycobacteriumok [3]), és 1990 óta 14 millió leprás beteget kezeltek világszerte. A betegség ellen folytatott ádáz küzdelemnek és a többféle antibiotikumból (dapszon, rifampicin és clofazimin) álló terápiának köszönhetően 2011-ben már “csak” közel 200 ezer új leprás fertőzést regisztrált a WHO [2].
 A szerelem nem mindig ismer (és tisztel) fajhatárokat, főleg, ha közeli rokon fajokról van szó.
A szerelem nem mindig ismer (és tisztel) fajhatárokat, főleg, ha közeli rokon fajokról van szó.

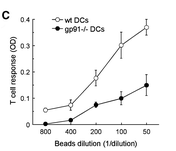 A jelen cikk egy lépéssel közelebb visz minket a cross-prezentáció megértéséhez. Az immunrendszer sejtjei a kórokozókat normális körülmények között bekebelezik, amik így egy sejten belüli hólyagocskába (fagoszóma) kerülnek. A fagoszóma pH-ja egy rövid lúgos szakasz után erősen savassá válik, a membránban ülő V-ATP-áz nevű fehérjének köszönhetően, emiatt a fehérjéket az emésztő enzimek gyorsan alkotóelemeikre bontják. A cross-prezentáció során azonban szükség van minimális méretű fehérjeszakaszok megőrzésére, egyébként nem történhet meg a felismerés a T-sejtek által. Különböző genetikailag módosított egértörzseken végzett kísérletek során most kiderült, hogy dendritikus sejtekben, amelyek képesek cross-prezentációra, a fagoszómák lúgosodását okozó NOX2 fehérje jóval aktívabb, így a pH nem csökken le annyira. Ennek az a következménye, hogy a fehérjék csak részlegesen bomlanak le és az így megmaradó megfelelő hosszúságú szakaszok elegendő specificitást biztosítanak a T-sejtek által való felismeréshez.
A jelen cikk egy lépéssel közelebb visz minket a cross-prezentáció megértéséhez. Az immunrendszer sejtjei a kórokozókat normális körülmények között bekebelezik, amik így egy sejten belüli hólyagocskába (fagoszóma) kerülnek. A fagoszóma pH-ja egy rövid lúgos szakasz után erősen savassá válik, a membránban ülő V-ATP-áz nevű fehérjének köszönhetően, emiatt a fehérjéket az emésztő enzimek gyorsan alkotóelemeikre bontják. A cross-prezentáció során azonban szükség van minimális méretű fehérjeszakaszok megőrzésére, egyébként nem történhet meg a felismerés a T-sejtek által. Különböző genetikailag módosított egértörzseken végzett kísérletek során most kiderült, hogy dendritikus sejtekben, amelyek képesek cross-prezentációra, a fagoszómák lúgosodását okozó NOX2 fehérje jóval aktívabb, így a pH nem csökken le annyira. Ennek az a következménye, hogy a fehérjék csak részlegesen bomlanak le és az így megmaradó megfelelő hosszúságú szakaszok elegendő specificitást biztosítanak a T-sejtek által való felismeréshez.