A tumorimmunológia fejlődésének köszönhetően az elmúlt pár év valódi áttörést hozott a rákkutatásban ami az elkövetkező időszakban nagy valószínűséggel alapvetően megváltoztatja a jelenlegi kezelési eljárásokat. Az új gyógyszerek közös neve immunmoduláló antitestek vagy immune checkpoint inhibitor-ok.
Az eredmények jelentőségét jelzi, hogy a Science magazin a 2013-as év tudományos áttörésének nevezte az elért eredményeket, a szakterület atyjának tekintett James P. Allison pedig a napokban kapta meg a rangos Lasker DeBakey Clinical Research Award-ot. A sikerek azonban nem jöttek könnyen, a tumorimmunológia több évtizednyi sikertelenség után jutott el a klinikai eredmények fázisába. Ebben a cikkben a különböző tumorellenes immunterápiás eljárásokrol lesz szó, különös tekintettel a fent is említett és legígéretesebbnek tartott ún. checkpoint inhibitor antitestekre.
Korai immunterápiás kísérletek
Paul Erlich már a múlt század elején megfogalmazta, hogy immunrendszer hiányában a tumorok nagyobb eséllyel alakulhatnak ki. A pár evtizeddel később kidolgozott immun-surveillance elmélet szerint immunrendszerünk folyamatos, láthatatlan harcban áll a rákos transzformáción átesett sejtjeinkkel. A tumorsejtek genomiális instabilitás révén onkogén mutációkkal a darwini szelekció eszközeivel harcolnak, és klinikailag diagnosztizálhato tumor csak abban az esetben jelenik meg, ha a tumorsejtek állnak nyerésre.
Ebből a gondolatmenetből logikusan következett, hogy immunrendszert mobilizálni lehetne a rák ellen. Hosszú évtizedek óta folynak az erre irányuló kísérletek. Abból a megfigyelésből kiindulva, hogy bakteriális eredetű bőrfertőzés egyes rákos betegekben a tumor visszahúzódásához vezetett, eleinte általános immunaktivációval próbálkoztak, pl. BCG mycobacteriumok helyi injektálásával, ám ezek a próbálkozások csak mérsékelt sikereket hoztak.
Később, hasonlóan a kórokozók elleni vakcinációhoz, tumor-specifikus antigének (tumorantigénekkel, azaz tumorokon jelenlévő molekulákkal) elleni vakcinációkkal kísérleteztek. A kialakuló sejtes immunválasz, konkrétan az ún. citotoxikus T sejtek (T limfociták), elpusztítják a tumor sejteket, pont úgy, mint a vírusfertőzött sejteket. Annak ellenére, hogy sikerült bizonyítani, hogy tumorellenes T sejtek létrehozása lehetséges, a klinikai tesztek során az átütő sikerek elmaradtak. A közelmúltban ugyan engedélyezték az USA-ban az első tumorvakcinát (Provenge) prosztatarák ellen, ám a minimális terápiás hatás és a komplikált kórházi kezelés (minden páciensnek egyedileg kell elkészíteni a vakcinát) miatt ez nem lett széles körben elterjedt.
A tumorellenes vakcinációk sikertelenségének egyik fő oka az immuntolerancia. Immunrendszerünkben többrétű mechanizmus gondoskodik arról, hogy a szervezet saját strukturái ellen ne alakuljon ki immunválasz, megelőzve ezzel az autoimmun betegégek kialakulásat. Így azok a T sejtek, amit saját struktúrákat ismernek fel a T sejtek fejlődése során kiszelektálódnak. Minthogy a tumorantigének legtöbbször saját strukúrák (esetleg több termelődik belőlük, vagy épp nem ott ahol kéne) egy hatékony tumorellenes immunválasznak potenciálisan ezt a toleranciát kéne attörnie. A klinikai sikerek hiányában egyre növekvő szkepticizmus jellemezte a tumorimmunológia területét.
Az antitest terápiák sikere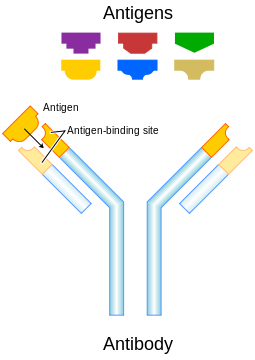
A sejtes immunválasz mellett a humorális immunválaszt, tehát antitesteket (ellenanyagok) is rendelkezhetnek tumorellenes hatással (1 ábra). Ezek a feherjék nagy specificitással képesek kötődni egy adott antigénhez (tehát molekuláris strukturákhoz, pl. baktériumokon vagy vírusokon), neutralizálva azt vagy immun-aktivációt indítanak el. A monoklonális (csak egy adott specificitásu) antitestek laboratóriumi előállításával lehetőve vált az ún. passzív immunizáció tumorellenes antitestekkel. A sejtkultúrákban (in vitro) látott egyértelmű tumorellenes hatás ellenére az első klinikai próbálkozások rendre kudarcba fulladtak. Ennek az oka az volt, hogy egér monoklonális antitesteket használtak emberekben, ami ellen rövid időn belül az emberben neutralizáló anti-egér ellenanyagok termelődtek. Ezt a problémát a humanizált (az egér-eredetű szekvenciákat emberivel helyettesítő), illetve a teljesen humán ellenanyagokkal sikerült nagyrészt kiiktatni, és igy már a klinikai sikerek sem maradtak el. Jelenleg az antitest terápia a gyógyszerfejlesztés legdinamikusabban fejlődő területe: több mint 40 antitest van klinikai használatban és több száz másik pedig fejlesztés alatt. Ezek az antitestek különféle módon képesek tumorellenes hatást kifejteni; egyrészt direkt tumorellenes hatás, pl. növekedési hormon receptorok esetében gátolhatják a ligand kötődést, vagy receptor internalizáciot válthatnak ki. Sok antitest tumorellenes immunmechanizmusokat aktivál, pl. makrofágok (ölősejtek) vagy a komplement rendszer aktiválasa útján. De az is előfordul, hogy az antitest a tumor vérellátását gátolja és ezáltal fejt ki tumorellenes hatást (2 ábra).
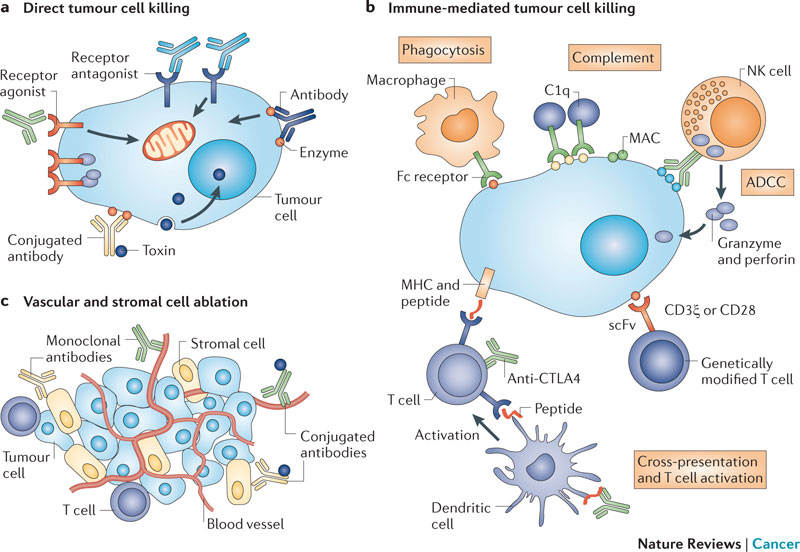
Egy sikeres antitest terápiának azonban elengedhetetlen feltétele egy olyan sejtfelszíni antigén ismerete, ami tumorspecifikus tehát tumorsejteken (lehetőleg az összesen) nagy számban legyen jelen, viszont hiányozzon az egészséges sejtekről. Sajnos igazán jól használható, nagy specificitású, tumorantigénekből pedig nincs túl sok. Ha van is, a gyorsan mutálódó tumor sok esetben megtalálja a módját, hogy kibújjon a támadás alól, pl. lecsökkenti az adott receptor expresszióját (antigén moduláció).
Az ún. checkpoint inhibitor antitestek abban különböznek alapvetően a klasszikus tumorellenes antitestektől, hogy nem maga a tumor ellen iranyulnak, hanem az immunrendszer sejtjei és molekulái ellen. Ennek számos előnye van; egyrészt nem (vagy legalábbis nehezebben) alakul ki rezisztencia a kezelés ellen. Továbbá nem kell pontosan ismerni a tumorantigént, ami elvileg minden tumortípusban, sőt az egyes páciensekben is más és más lehet. De a legnagyobb előny, hogy ily módon tartós immunválasz hozható létre a tumor ellen, és a mutálódó tumorral így lépést tud tartani az immunrendszer, ami akár a tumor teljes elpusztításához is vezethet.
A T sejt aktiváció mechanizmusa
Ehhez a forradalmian új terápiához vezető hosszú út ebben az esetben is alapkutatással kezdődött, mégpedig azon lelkes kutatóknak köszönhetően, akik révén az elmúlt évtizedekben részleteiben is megismertük a T sejtes antigén felismerés lépéseit és az ezt szabályozó folyamatokat. Az antigén prezentáció és az ezt követő T sejt aktiváció az immunfelismerés kulcsfontosságú mozzanata, ami alapján immunrendszerünk különbséget tesz saját és idegen struktúrak között.
Minden T sejt egy egyedi receptort hordoz a felszínén, ez az ún. T sejt receptor (TCR), amely egy bizonyos peptidláncot ismer fel, azaz ehhez kötődik specifikusan. A peptidláncot az MHC (major histocompatibility complex) molekula „mutatja be” az antigén prezentáló dendritikus sejtek felszínén. A TCR a peptidet az MHC-val együtt ismeri fel. A TCR-peptid-MHC interakció adja az antigén felismérés specificitását. Később világossá vált, hogy ez az interakció szükséges, ám nem elégséges a T sejt aktivációhoz. Szükség van egy második szignálra, amit az ún. kostimulációs molekulák és ezek ligandjai biztosítanak, ennek hiányában T sejt válaszképtelenség (anergia) alakul ki. A kostimulációs receptorok mellett pedig vannak olyanok, amik éppenhogy gátló funkcióval bírnak. A dendritikus sejt és a T sejt interakciója során számos kostimulációs és gátló receptor szofisztikáltan szabályozoza a T sejt aktivációt (3 ábra). Az egyes T sejtek sorsát tehát az egyszerre beérkező aktiváló és gátló jelek eredője határozza meg.
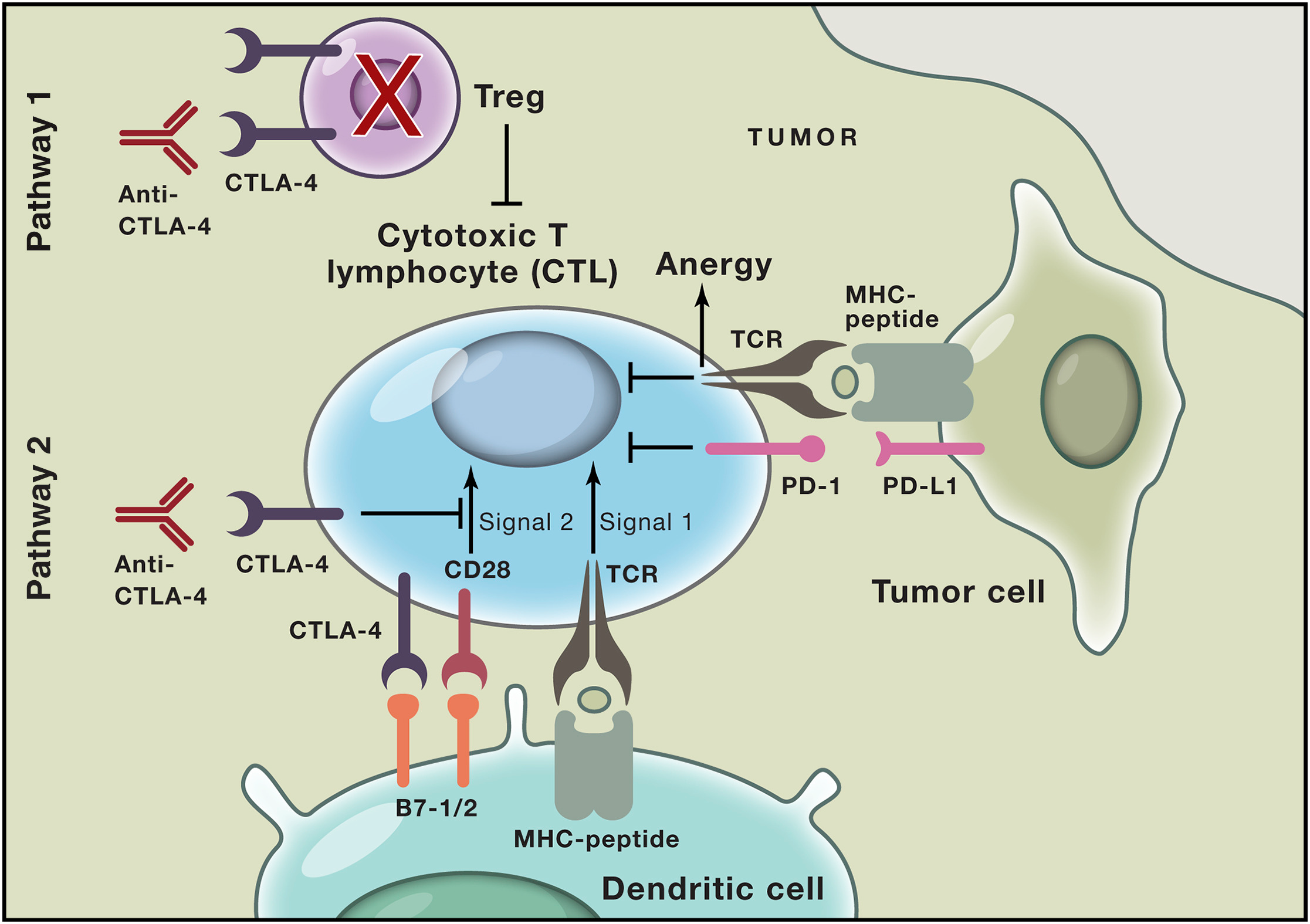
Elsőként a B7-CD28 interakciót ismertük meg. A dendritikus sejtek veszély (pl. fertőzés) esetén aktiválódnak és ennek során a B7 molekulát expresszálják a membránjukon. A B7 kötődik a CD28-nak nevezett sejtfelszíni molekulához a T sejt felszínén és ez a kötődés adja a második aktivácios jelet a T sejtnek (3 ábra). Ezáltal csak az antigént specifikusan felismerő T sejtek aktiválódnak. A felismerés eredményeként összetett aktivációs program indul, a T sejt osztódni kezd (proliferáció), a sejtek specifikus effector funciókra (pl. citokinek termelése, ölő funció), tesznek szert és a fertőzés helyére vándorolva elpusztítják a betolakodókat. Így viszonylag rövid időn belül egy egész hadseregnyi T sejt áll az szervezet rendelkezésére.
Hamar világossá vált, hogy léteznek szabályozó mechanizmusok, amik arról gondoskodnak, hogy ez a T sejtes immunválasz időben véget érjen, megelőzve a kontrollálatlan T sejt osztódást és a szükségtelen immun-aktivációt. Ezek a kontroll pontok, ún. checkpoint-ok felelnek azért, hogy ne alakulhasson ki nem kivánt T sejtes immunválasz, valamint a T sejt aktiváció időben lecsengjen.
CTLA-4, a prototipikus checkpoint molekula
Az első ilyen molekula a CTLA-4 (cytotoxic T lymphocyte antigen 4) volt. Az aktiváció után a T sejtek a gátló funkciójú CTLA-4-et expresszálnak, ami ugyanúgy kötődik a B7-hez, csak erősebben, mint a stimuláló funkciójú CD28, ezáltal kompetíció lép fel és az immunválasz lényegében leszabályozza önmagát. A CTLA-4 általi gátlás fontosságát egyértelműen mutatja hogy olyan genetikailag módosított egerekben, akikben hiányzik a CTLA-4 gén, szabályozatlan T sejt aktiváció és osztódás figyelhető meg, ami az egerekben súlyos, pár hét alatt végzetes autoimmun tüneteket okoz.
Elsőként 1996-ban James P. All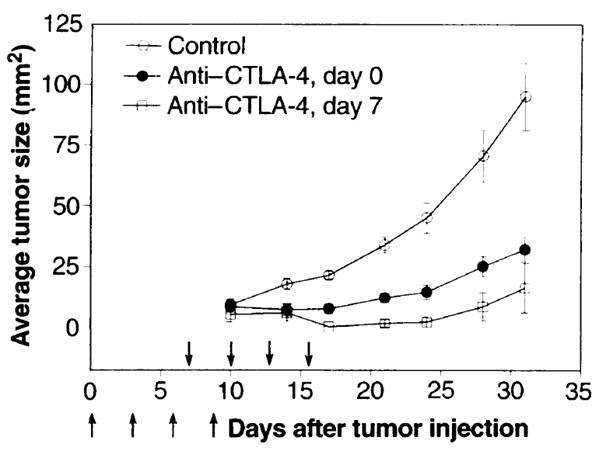 ison gondolt arra, hogy a CTLA-4 funkciójának blokkolásával a tumorellenes T sejt válasz hatékonyságát növelje. Az ő laborjában mutatták be először, hogy egy blokkoló hatású anti-CTLA-4 antitest egermodellekben hatékony tumorellenes hatást indukál (4 ábra). Különösen érdekes volt, hogy ezen antitestek tumorellenes immunológiai memóriát alakítottak ki, így az egerek ellenállóak lettek az újabb tumor beültetésekkel szemben.
ison gondolt arra, hogy a CTLA-4 funkciójának blokkolásával a tumorellenes T sejt válasz hatékonyságát növelje. Az ő laborjában mutatták be először, hogy egy blokkoló hatású anti-CTLA-4 antitest egermodellekben hatékony tumorellenes hatást indukál (4 ábra). Különösen érdekes volt, hogy ezen antitestek tumorellenes immunológiai memóriát alakítottak ki, így az egerek ellenállóak lettek az újabb tumor beültetésekkel szemben.
A preklinikai (tehát egerekben végzett) sikerek ellenére Allisonnak nem kis nehézségébe telt meggyőzni a gyógyszercégek képviselőit, hogy támogassák a klinikai kísérleteket. Akkoriban az elképzelés, hogy nem a tumort, hanem az immunrendszert célozzák nagyon szokatlan volt, valamint a CTLA-4 hiányos egerek letális fenotípusa okán tartottak a lehetséges mellékhatásoktól. Végül a Bristol-Myers Squibb kifejlesztett egy CTLA-4-et blokkoló klinikai antitestet, ami az ipilimumab (Yervoy) nevet kapta (a terápiás antitestek nomenklatúrája az első benyomás ellenére bizonyos mértékig logikus rend szerint történik).
Az ipilimumab-ot először előrehaladott stádiumú, és már többféle kezelésen átesett melanómás betegeken tesztelték. Ebben a rossz prognózisú pacienscsoportban korábban még sosem sikerült hatékony szert leírni. A különböző klinikai paraméterek tekintetében az ipilimumab hatékonynak bizonyult, de az igazán megdöbbentő az volt, hogy a paciensek egy csoportjában a rák teljesen eltűnt. Eddig kb. 5000 melanóma pacienst kezeltek ipilimumabbal, és 22%-uk 10 évvel később is életben volt csupán egy kezelési ciklus után. A teljes gyógyulás egészen elképesztő eredmény ebben a pacienscsoportban, ahol korábban a legjobb gyógyszerek is mindössze pár hónappal tudták meghosszabbítani a betegek életét.
A PD-1 – PD-1L tengely
Az anti-CTLA-4 antitest hatására a többi ún. checkpoint inhibitor molekula is az érdeklődés középpontjába került, ezek közül pedig a PD-1 (programmed cell death 1) – PD-1L (ligand) interakció tűnt a legfontosabbnak. A PD-1 szintén egy gátló receptor T sejteken, de más sejteken is jelen van. A CTLA-4-B7 interakcióhoz hasonlóan, a PD-1 – PD-1L molekuláris interakciónak is hasonló szerepe van, de nem a nyirokcsomókban, a korai T sejt aktiváció során, hanem inkább a tumor közvetlen környezetében (tumor microenvironment). Daganatokból már régebben is izoláltak tumorspecifikus T sejteket, de ezeket a tumor többféle mechanizmus útján képes gátolni. Hogy kivédjék a T sejtek támadását, a tumorsejtek trükkösen PD-1L-ot expresszálnak, ami kötődik a tumorspecifikus T sejtek felszínen lévő a PD-1-hoz és ezáltal gátolja a T sejt ölő funkcióit. Ezt az interakciót lehet mind PD-1, mint PD-1L ellenes antistekkel blokkolni, aminek következtében (a CTLA-4 blokkolásához hasonlóan) a legátolt T sejtek felszabadíthatók a gátlás alól, ami hatékony tumorellenes immunválaszt eredményez.
A PD-1 ellenes klinikai antitestek közül a nivolumab (Opdivo) fejlesztése tart a legmesszebb, számos tumortípus esetében észleltek klinikai hatást, ami sok esetben tartós is volt. A másik PD-1 ellenes antitest a pembrolizumab (Keytruda), ami szintén hatékonynak bizonyult előrehaladott állapotú melanomás betegeken. Ezen kívül a PD-1L ellen is fejlesztenek antitesteket, amik szintén a klinikai tesztelés fázisában vannak.
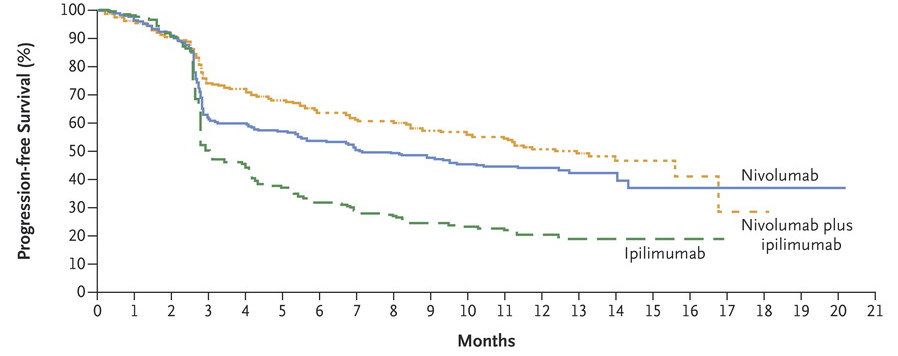
Arra is van bizonyíték, hogy az immunmoduláló antitestek kombinálhatók a klasszikus rákterápiákkal (kemoterápia, radioterápia, célzott molekuláris terápiák stb) és együtt talán szinergikusan is működhetnek. Emellett folynak a klinikai tesztek checkpoint inhibitor antitestek kombinációjával is; az ipilimumab és a nivolumab kombinációja az egyes antitesteknél is jobb hatást eredményezett (5 ábra).
Az immunterápia reneszánsza
Az ipilimumab és a nivolumab sikereit látva manapság már senki sem kételkedik a tumor-immunterápia hatékonyságában. Ezen két molekulán kívül még számos gátló funkcióju T sejt receptor-ligand párt írtak le, amik ellen gőzerővel zajlik a blokkoló (tehát antagonista hatású) antitestek fejlesztése és tesztelése. A gátló receptorok mellett a kostimulációs molekulák ellen pedig stimuláló (vagyis agonista) antitesteket fejlesztenek, amiknek révén az immunválaszt erősíteni lehetne. Az egyik elso ilyen ún. agonista antitest a rossz emlékű CD28 ellenes TGN1412 (TeGenero) volt, aminek első emberi tesztje során a masszív immunaktiváció miatt súlyos mellékhatások léptek fel. Ezt követően az agonista antitestek egy ideig nem is tűntek túl attraktívnak, de a TGN1412 kudarcábol leszűrt tapasztalatokat hasznosítva már számos ilyen antitest fejlesztése zajlik. A blokkoló és a stimuláló, tehét immunmoduláló antitestek óriási terápiás lehetőségeket nyitottak meg és mára már minden magára valamit is adó pharma cégnek van ezen a területen fejlesztés alatt álló antiteste.
Érdekesség, hogy az ipilimumab klinikai tesztjeinek korai fázisában majdnem lefújták az egész programot. Egyrészt a gyulladásos mellékhatások okoztak aggodalmat a felügyeleti szerveknel. Másrészt, a kemoterápiás szerek direkt tumor ellenes hatásábol kiindulva tradícionálisan tumor növekedést néztek, és a betegekben az ipilimumab beadása után a tumor további növekedést mutatott, sőt, esetenként még gyorsabban is növekedett. A tumorellenes immunválasz kialakulásahoz idő kellett, és ma már tudjuk, hogy a növekedés csak látszólagos volt, amit a tumorba vándorló számos citotoxikus T sejt okozott.
Mivel a tradícionális kemoterápiás szerek azonnal blokkolják a tumor novekedését, és az új gyógyszerek eredményességét a WHO kriteriumai szerint a tumor növekedés alapján bírálják el. Ennek alapján viszont sok olyan beteg a “nem reagál” kategóriába volt sorolható, akik később teljes gyógyulást mutattak. Mivel az immunmoduláló antitestek antitumor mechanizmusa más, így a klinikai tesztek paramétereit is újra kellett értékelni, és most már az immunaktivációt (immune-related response criteria (irRC)) néznek. Tumornövekedés helyett érdemesebb volt túlélést (overall survival) nézni.
Miután ezen terápiák lényegében általános, tehát nem-specifikus immunaktivációt okoznak, adódik a kérdés, mik a mellékhatások. Nem túl meglepő módón mind az ipilimumab, mind nivolumab terápia alatt különböző gyulladásos tünetek figyelhetők meg (immune-related adverse events (irAEs)), amik legtöbbször a bélrendszerben, májban, és a bőrben jelentkeznek. Ezen mellékhatások súlyossága összehasonlítható a kemoterápia vagy a célzott molekuláris terapiák mellékhatásaival. Szerencsére ezek egyrészt jól kezelhetők szteroidokkal, másrészt visszafordíthatók, tehat az ipilimumab kezelés elhagyása utan elmúlnak. Nem szabad megfeledkedni arról sem, hogy ezek a mellekhatások a vizsgált betegcsoportokban elfogadható kockázatot jelentenek.
A jövő útjai
A millió dolláros kérdés jelenleg az, hogy miért csak a páciensek 20-30%-ában jön létre teljes és tartós gyógyulás, illetve léteznek-e olyan biomarkerek ami alapján előre meg lehet jósolni, hogy reagál valaki ezen kezelésekre. Első körben az ilyen terápiák alatt az immunrendszer sejteit és molekuláit kell alaposan megismerni (immune monitoring), hogy kiderüljön, milyen paraméterek korrelálnak a sikeres kezeléssel, pontosan milyen immunfolyamatok (sejtek és molekulák) érik el a tumor visszaszorítását. Egyelőre azt találták, hogy az ipilimumabbal sikeresen kezelt betegekben a vérben keringő limfociták száma magasabb. Legalább ugyanilyen fontos megismerni a tumor közvetlen környezetében zajló folyamatokat.
Kérdéses továbbá, hogy vajon minden tumortípusra alkalmazható-e ez a terápia. Elvileg igen, hiszen nem a tumort kezeljük, hanem az immunrendszert. Az például már látszik, hogy az immunogén, tehát gyorsan mutálódó tumortípusokra (pl. melanóma) alkalmasabbnak tűnik, mint a relatív kevés szomatikus mutációt hordozó tumortípusok ellen. Ennek az a magyarázata, hogy az immunrendszer az egyes tumoros mutációkat (neoantigéneket, tehát megváltozott saját antigéneket) ismeri fel. A tumorok teljes genomszekvenálása megmutathatja, hogy melyek ezek az immunológiailag releváns neoantigének, amik megléte valószínűleg szükséges a hatékony kezeléshez. A melanóma mellett a tüdőrák egyes típusaiban, vesetumorokban, illetve prosztatarákban is tesztelték ezeket az antitesteket, és a korai (I-es fázisú) tesztek szerint itt is hasonlóan hatásosak voltak.
Jelenleg számos nagy mintaszámú (III-as fázisú) klinikai teszt van folyamatban különböző tumortípus esetén, és arra lehet szamítani, hogy a következő években ezek eredményei uralni fogják a szakmai konferenciákat és valószínűleg a híroldalak tudományos rovatait.
Ezzel párhuzamosan a biotech és pharma cégek őrült versenyt futnak egymással az új és igéretes immunmoduláló antitestekért. A potenciális piac ugyanis óriási. Ezek a modern terapiák nagyon sokba kerülnek (pl. egy ciklus ipilimumab kezelés 120 ezer dollár), amik egyre nagyobb terhet rónak az egészségbiztosítókra világszerte. Mivel ez az állapot egyre kevésbé fenntartható (különosen két-három antitest kombinációja esetén), valószínűleg új tárgyalások lesznek szükségesek. Ezzel együtt, ezek az antitestek akár egy kezelési ciklus után is tényleges gyógyulást hozhatnak, ami megkérdőjelezhetetlen előrelépés a jelenleg elérhető gyógyszerekhez képest, amik a legjobb esetekben is csak hónapokkal hosszabbítják meg a betegek életét.
Ezen antitestek sikere rávilágít az egér kísérletek fontosságára, hiszen a különböző mutáns (knockout) egértörzsek segítségével derült fény a T sejt aktivációt szabályozó molekulák funkciójára, valamint a terápia eredményességét is először egereken sikerült demonstrálni.
A rákkutatásban a fejlődés többnyire kis lépésenként történik, igazi nagy áttörések nélkül. Az immunmoduláló vagy checkpoint inhibitor antitestek a rákkezelés radikális megváltozását igérik. Egyes orvosok azt sem zárjak ki, hogy némely ráktípusok esetén az immunmoduláló antitestek a jövőben akár a kemo- és radioterápiát is helyettesíthetik, és első vonalban lehet majd őket bevetni a terápiában. Hogy az valóban így lesz-e, azt nem jelenleg nem tudjuk, annyi azonban biztos, hogy a tumor-immunterápia területe hallatlanul izgalmas évek elé néz.
Littman, D.R. Cell. 2015 Sep 10;162(6):1186-90
Lesokhin, A.M. et al, Science Translational Medicine. 2015 March Vol 7 Issue 280 280sr1
Sharma P. and Allison J.P. Cancer Immunology and Immunotherapy. 2015 April Vol 348 Issue 6230
Sharma P. and Allison J.P. Cell. 2015 161, April 9 205
Postow M.A. et al. Journal of Clinical Oncology. 2014, 59.4358
Leach DR et al, Science. 1996 Mar 22;271(5256):1734-6.
Andrew M. et al, Nature Reviews Cancer 12, 278-287 (April 2012)
Borítókép: ImmunoCellular, 2. ábra forrása: Wikipedia https://en.wikipedia.org/wiki/Antibody

Ha jól értem, ez az iskola nem foglalkozik a tumor kiváltó okaival, hanem csak egy újabb irány a betegség kezelésére. Van esély valaha olyan genetikai alapú terápiára, ami eleve a tumorképződést akadályozza meg? Vagy ötszáz év múlva is mindig az áttörés peremén fognak állni a kutatók? Laikusként én az utóbbira szavazok. Volt nemrég egy hasonlóan érdekes riport az indexen: index.hu/tudomany/egeszseg/2015/06/11/mar_megvan_a_modszer_amivel_legyozheto_a_rak/
Ezek alapján azt hihetné az ember, hogy tényleg létezik áttörés, és csak ki kell várni, a módszerek azonban alig változnak, rákbetegből pedig egyre több lesz. Persze tudom, hogy a rák nem egyetlen betegség, hanem ezerféle, és nincs biztos módszer, ami mindre jó. De nagyon úgy tűnik, hogy az idő nem nekünk dolgozik.
A szerző kutató orvos? Ha igen, ha nem, mindenképp köszönet ezért a remek összefoglalóért és leírásért!
Remélem, hogy sok emberhez eljut!
Viszont addig nem lesz ezekből a terápiákból semmi itthon amíg a betegek illetve betegszervezetek nem harcolják ki. Sajnos nem úgy tűnik, hogy a magyar betegek érdekeit képviselő szervezetek a betegek érdekeit képviselnék…
Legutóbb azt olvastam, hogy évente 34mlrdot költünk daganatos terápiákra évente. Ezzel szemben köztévére 122Mlrdot. 122.000.000.000..jól írtam a 0-ákat? És ez csak a 6% os nézettségű “köz”tv, a stadionokról nem beszélve.
Évente kb 300 melanómás páciensnél történik áttét. Kb a 10% jut hatékony terápiához eg y jó évben.
A furcsa paradoxon az, hogy addig lehet itthon ilyen terápiákhoz jutni amíg kiterjesztett hozzáférési programok működnek(phase3 trial)
,ha engedélyezik,onnantól finanszírozni kéne és nincs rá keret,az OEP levelében pedig az elutasított méltányossági kérelem lesz.
és , hogy mit tud az Anti PD1:
http://www.smh.com.au/business/i-dont-want-to-die-i-still-have-things-to-do-keytruda-wins-ron-walkers-war-on-cancer-20150130-1323s8.html
Retrovirusnak: Jó levegő(alig van), jó víz(talán), jó minőségű étel, mozgás, ezekkel lehet megelőzni a rákot, de a genetika, családon belüli kórtörténet tudása is fontos. Rendszeres ön vizsgálat, szűrés még ha fizetni is kell érte. Mást nem tudsz tenni.
És sajnos pl. Németo ban 30% nagyobb a túlélési esélyed,mert ott a diagniosztika, a fenti gyógyszerek mind rendelkezésre állnak.
@retrovírus: A tumor immunológia valóban elsősorban a lehetséges kezelési módokkal foglalkozik és más tudományterületek foglalkoznak azzal, hogy miért és hogyan alakulnak ki daganatok.
A kérdésedre válaszolva, egyes öröklődő (csíravonal) mutációk jelenléte többszörösen megnöveli a daganatok jelentetet, közismert pl. a BRCA-1 gén mutációi és a mellrák közötti összefüggés. Elvileg elképzelhető, hogy ezek a mutációk helyreallíthatók a petesejtben vagy a hímivarsejtben, de jelenleg ez sem technikai sem etikai okokbol kifolyólag nem kivitelezhető. A fő gond azonban, hogy az ilyen öröklődő mutációk csak a daganatok kis részéért felelnek, messze a legtöbb daganatot szerzett (szomatikus) mutációk okoznak, amiket viszont nem lehetséges genetikai úton kezelni.
Szintén a tumor immunológiának köszönhetően viszont bizonyos esetekben a daganatok teljes megelőzése ma már realitás. Egyes vírusok (onkovírusok), illetve baktériumok képesek daganatokat előidézni. Ebben az esetben a vírusok elleni vakcináció védettséget biztosít a daganatok ellen. Erre jó példa, hogy a humán papilloma vírus (HPV) elleni oltással példaul a méhnyakrák megelőzhető.
Az linkelt – meglehetősen szenzációhajhász címü – index cikkben, a célzott molekuláris terapiákról van szó. Valóban igaz, hogy ezek a szerek hatékonyak, és ha ismert mutáció ellen a megfelelő terápiát vetik be, akkor a daganat visszaszorítható. Ám mivel a tumorsejtek rendkívül gyorsan mutálódnak, a legtöbb esetben rezisztencia alakul ki, amivel a tumor lényegében kijátsza a gyógyszer blokkoló hatását.
Arról persze lehet vitatkozni, hogy milyen esetben megalapozott az “áttörés” kifejezést használni. Szerintem akkor mindenképpen indokolt, ha egy új eljárással egy egyébként menthetetlen betegcsoport 20%-át meg lehet gyógyítani.
@UZoltan
Való igaz, hogy hatalmas különbségek vannak egyes országok és régiók között, míg egyes afrikai országokban a mütét vagy a sugárkezelés sem rutin, a fejlett országokban pedig a legújabb gyógyszerek is elérhetők, persze nem mindig és nem mindenkinek.. Én nem látom át hogy ez az egyes országokban pontosan hogyan müködik.
@aspicio: Köszi a részletes választ. Én az áttörés alatt tényleg sokkal nagyobb volumenű dolgot értenék, de ez szemantikai kérdés. Ez alátámasztja azt, amiben eddig is hittem, hogy a rákra igazából soha nem lesz egyszerű és biztos gyógymód, tekintet nélkül az orvostudomány és a biológia fejlettségére. 500 év múlva is valószínűleg ugyanilyen vezető halálok lesz. Illetve hogy a fő rizikófaktor továbbra is az idős kor lesz, hiszen amennyire laikusként tudom, a DNS minden osztódásával új mutációk jönnek létre (javíts ki, ha tévedek). Hogy mikor törik el valami végzetesen, teljesen véletlenszerű.
A Zeitgeist második vagy harmadik részében van egy rövid riport egy rákkutatóval, és azt mondja, hogy nem mindenkiben fejlődik ki pl. a mellrák, akiben megvannak az erre hajlamosító gének, ugyanakkor sok olyanban is kialakul, akiben nincsenek meg.
Szerintem az életmódnak rendkívül kicsi, szinte elhanyagolható a szerepe ebben. Legalábbis sokkal kisebb, mint a közhiedelem tartja. Sok olyan is megbetegszik, akiről azt hinnéd, hogy minden rendben van vele: aktív sportolók, egészségesen és lelkileg kiegyensúlyozottan élő fiatal emberek. Totál random, hogy mikor kerülsz sorra.
Azért jó, hogy valakik ezt kutatják, csak nem úgy tűnik, mintha ők állnának nyerésre. Persze a leghosszabb út is az első lépéssel kezdődik.
@retrovírus: “Sok olyan is megbetegszik, akiről azt hinnéd, hogy minden rendben van vele:”
A külső rizikófaktoroknál nem biztos hogy mindenről tudunk. Pl sokáig az azbeszt jó építőanyagnak tűnt de aki azbeszttel szigetelt öltözőjű sportlétesítménybe járt sportolni az esetleg nagyobb rásegítést kapott a tüdőrákja kialakulásához mint aki nem sportolt. Nem pánikkeltésként de a híresneves csernobil-para mellett nem esik szó egyéb helyekről amik szintén a bolygó felszínén vannak és hatással a környezetükre. Ez utóbbi azért tartalmaz “random” elemeket, az hogy egy nagy utazó porszem ami pont sugárzó, esetleg szerencsésen eljut a légkörben cseljabinszktól egészen a te sejtjeidig, tényleg eléggé véletlen-/sors-szerű.