 Az állatvilágban közel sem szokatlan, ha egy-egy faj egyedei már embrionális fejlődésük után, de még felnőtté válásuk előtt nagyarányú változáson esnek át (gondoljunk csak a lábat növesztő ebihalakra), a lepényhalak esete azonban mégis külön említést érdemel.
Az állatvilágban közel sem szokatlan, ha egy-egy faj egyedei már embrionális fejlődésük után, de még felnőtté válásuk előtt nagyarányú változáson esnek át (gondoljunk csak a lábat növesztő ebihalakra), a lepényhalak esete azonban mégis külön említést érdemel.
Önmagában az, hogy ezek a halak a vízfenék közelében szeretnek élni és ez a viselkedés egy erősen ellaposodott testalkattal párosodott még nem szenzáció. Mint azt a ráják esete is mutatja, el lehet mindezt úgy is érni, hogy a oldalirányban ellaposodik a testfal és közben a főbb szervek ugyanott maradnak, mint más gerincesekben. A lepényhalak azonban más utat választottak: kvázi az oldalukra “fordultak”, s hogy mégis hasznát lássák annak, hogy a gerincesek esetében a szem páros szerv, az aljzat oldalán levő szemüket a szó szoros értelmében “átvándoroltatják” a másik oldalra.
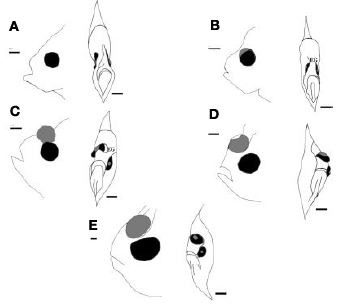 A vándorlás kapcsán azért indokolt a jelenidő, mert ezt a folyamatot minden egyes halnak le kell “játszania” élete során – ugyanis a lepényhalak életük kezdetén még igencsak “normálisak”, s szemük a test két oldalán helyezkedik el (jobb oldali ábra, A). Igaz, ezek a fiatal halak még függőleges testhelyzetben úszkálnak, s ezen viselkedésük is csak a fizikai átalakulásuk, ún. metamorfózisuk (B-E) végére változik meg.
A vándorlás kapcsán azért indokolt a jelenidő, mert ezt a folyamatot minden egyes halnak le kell “játszania” élete során – ugyanis a lepényhalak életük kezdetén még igencsak “normálisak”, s szemük a test két oldalán helyezkedik el (jobb oldali ábra, A). Igaz, ezek a fiatal halak még függőleges testhelyzetben úszkálnak, s ezen viselkedésük is csak a fizikai átalakulásuk, ún. metamorfózisuk (B-E) végére változik meg.
Maga az átalakulás elsősorban a tiroxin (T4) nevű pajzsmirigyhormonnak köszönhető: hacsak a hal nem éhezik, akkor lárvakorának végén a hormonszint megemelkedik, beindítva azokat a változásokat, amelyek a jobboldali szem átvándorlásához vezetnek. (Ha mesterségesen lenyomjuk a hormonszintet, a metamorfózis elmarad.) Ezen folyamatok közül a legtöbb az arckoponyát érinti, szinte a teljes “arcberendezést” át kell végül alakítani: azon az oldalon, ahonnan elvándorol a szem, bizonyos csontoknak növekedniük kell, hogy kitöltsék az üresen maradó helyet, míg a túloldalon a csontozatnak fel kell készülnie a szem befogadására.
Hogy az evolúció során pontosan miként is alakult ki ez a furcsa külalak, sok fejtörést okozott. Mivel szinte valószerűtlennek tűnhet, hogy itt is egy fokozatos változásról legyen szó (mert ugye mire jó egy félig átvándorolt szem), egyesek szerint a lepényhalak egyértelmű cáfolatai voltak az evolúciónak (bővebben lásd a Loom-on), a biológusok közül pedig sokan merészen azt sugallták, hogy gyakorlatilag egyetlen mutáció okozta a változást. Utóbbi fejlődésbiológiailag soha nem tűnt életszerűnek (elég kicsi az esélye, hogy egy ennyire összetett folyamat egyetlen, vagy akár csak kevés génre lenne visszavezethető) és a napokban kiderült, hogy tényleg nem is így történt.
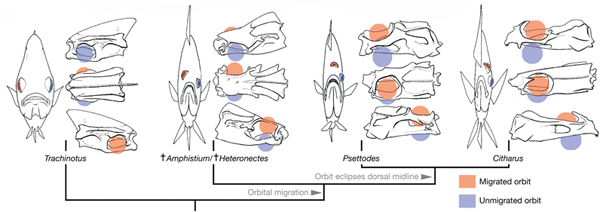
Ugyanis egyszerre két, a folyamatot dokumentáló, “átmeneti fosszília” került elő – pontosabban került újra napvilágra, hiszen eddig egy múzeum mélyén porosodtak, várva, hogy egy figyelmes emberi szempár rájuk találjon. Végül Matt Friedman lett a szerencsés, s így az ő tolmácsolásában tudhattuk meg, hogy az Amphistium és a Heteronectes (mert ez a két fosszília becsületes latin neve) félig átfordult szemgolyóval élték felnőtt életüket. Innen pedig már csak egy lépés a jobb oldali szem középvonalra való átemelése (lásd a mas is élő homlokszemű halakat), majd végül a lepényhalak teljes egyoldalúsága. Persze a fosszíliák birtokában ismét előkerül a “mire volt ez nekik jó” kérdés, amire továbbra sincs tuti válaszunk. Annyi viszont biztos, hogy valamire mégis jó kellett legyen (pl. ezek a halak még nem folyamatosan a vízfenéken éltek, hanem csak annak közelében, így egyik szemükkel az aljzatot vizsgálták táplálékért, míg a másik a körülöttük levő víztömeget sasolta, hogy kiszúrja a ragadozókat), különben nem alakult volna ki.
Az átalakuló halak és a fosszilis csontok közti hasonlóság nem véletlenül szembeötlő: azon különleges esetek egyikét figyelhetjük itt meg, amikor az egyedfejlődés valóban ismétli a törzsfejlődést, és metamorfózisa során a hal többé-kevésbé ugyanazokon a stációkat járja meg, amelyek a faj evolúcióját is jellemezték.
(A post elején levő lepényhal portré innen van.)
Friedman M (2008) The evolutionary origin of flatfish asymmetry. Nature 454: 209-212.
Martinez GM, Bolker JA (2003) Embryonic and larval staging of summer flounder (Paralichthys dentatus). J Morphol 255(2): 162-176.
Sæle, Ø, Silva N, Pittman K (2006) Post-embryonic remodelling of neurocranial elements: a comparative study of normal versus abnormal eye migration in a flatfish, the Atlantic halibut. J Anat 209(1): 31-41. doi: 10.1111/j.1469-7580.2006.00577.x.
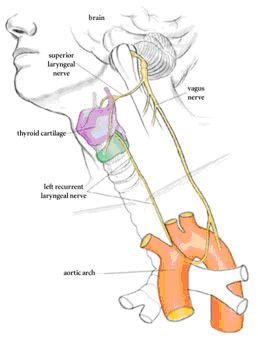 A “bolygóideg” (nervus vagus) neve nem teljesen véletlen, hiszen az agytörzsből kiindulva testünk egészen távoli pontjait is eléri. Egy leágazása azonban egészen különleges és bizarr utat jár be: ez az ún. alsó gége ideg (angolul – a képaláírások végett – recurrent laryngeal nerve).
A “bolygóideg” (nervus vagus) neve nem teljesen véletlen, hiszen az agytörzsből kiindulva testünk egészen távoli pontjait is eléri. Egy leágazása azonban egészen különleges és bizarr utat jár be: ez az ún. alsó gége ideg (angolul – a képaláírások végett – recurrent laryngeal nerve).
 Annak, aki már töltött több-kevesebb időt valamely történeti múzeum falai között, annak talán fölösleges ecsetelni egy klasszikus páncélzat előnyeit és hátrányait. Előny, hogy megvéd a külvilág “kellemetlen” hatásaitól, hátránya viszont, hogy súlya és felülete függvényében, valamennyire mindenképpen korlátozza a mozgást.
Annak, aki már töltött több-kevesebb időt valamely történeti múzeum falai között, annak talán fölösleges ecsetelni egy klasszikus páncélzat előnyeit és hátrányait. Előny, hogy megvéd a külvilág “kellemetlen” hatásaitól, hátránya viszont, hogy súlya és felülete függvényében, valamennyire mindenképpen korlátozza a mozgást.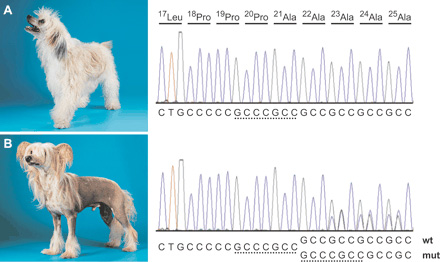 Mióta magunk alakítjuk (egyre hatékonyabban) a körülöttünk levő világot, fokozatosan átalakult a “rátermettség” definíciója is, mind a saját, mind a hozzánk kapcsolódó élőlények viszonylatában.
Mióta magunk alakítjuk (egyre hatékonyabban) a körülöttünk levő világot, fokozatosan átalakult a “rátermettség” definíciója is, mind a saját, mind a hozzánk kapcsolódó élőlények viszonylatában.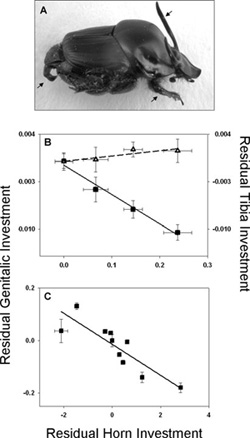 Laikusok számára talán meglepő módon, az Onthophagus genusba tartozó trágyabogarak azon fajok közé tartoznak, amelyeken a legjobban lehet
Laikusok számára talán meglepő módon, az Onthophagus genusba tartozó trágyabogarak azon fajok közé tartoznak, amelyeken a legjobban lehet  Az állatvilágban közel sem szokatlan, ha egy-egy faj egyedei már embrionális fejlődésük után, de még felnőtté válásuk előtt nagyarányú változáson esnek át (gondoljunk csak a lábat növesztő ebihalakra), a
Az állatvilágban közel sem szokatlan, ha egy-egy faj egyedei már embrionális fejlődésük után, de még felnőtté válásuk előtt nagyarányú változáson esnek át (gondoljunk csak a lábat növesztő ebihalakra), a  A vándorlás kapcsán azért indokolt a jelenidő, mert ezt a folyamatot minden egyes halnak le kell “játszania” élete során – ugyanis a lepényhalak életük kezdetén még igencsak “normálisak”, s szemük a test két oldalán helyezkedik el (jobb oldali ábra, A). Igaz, ezek a fiatal halak még függőleges testhelyzetben úszkálnak, s ezen viselkedésük is csak a fizikai átalakulásuk, ún. metamorfózisuk (B-E) végére változik meg.
A vándorlás kapcsán azért indokolt a jelenidő, mert ezt a folyamatot minden egyes halnak le kell “játszania” élete során – ugyanis a lepényhalak életük kezdetén még igencsak “normálisak”, s szemük a test két oldalán helyezkedik el (jobb oldali ábra, A). Igaz, ezek a fiatal halak még függőleges testhelyzetben úszkálnak, s ezen viselkedésük is csak a fizikai átalakulásuk, ún. metamorfózisuk (B-E) végére változik meg.
 Ha egyszer majd valaki veszi a fáradtságot, hogy összeállítsa, a legfélrevezetőbb magyar állatnevek listáját, a lándzsahal mindenképpen előkellő helyre fog befutni. Ugyanis ez a kis állat nem hal, de mégcsak nem is gerinces. Ettől persze a hasonlóság még valós, de közel sem annyira szoros rokonságot takar (mint látni fogjuk, sőt), mint azt a nevezéktan sugallja.
Ha egyszer majd valaki veszi a fáradtságot, hogy összeállítsa, a legfélrevezetőbb magyar állatnevek listáját, a lándzsahal mindenképpen előkellő helyre fog befutni. Ugyanis ez a kis állat nem hal, de mégcsak nem is gerinces. Ettől persze a hasonlóság még valós, de közel sem annyira szoros rokonságot takar (mint látni fogjuk, sőt), mint azt a nevezéktan sugallja.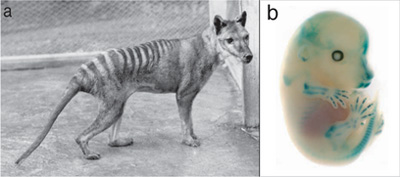 Szóval az erszényes farkas és a Col2A1 gén esete a magyar elektronikus médiával, avagy fiktív hírek a nagyvilágból. Pontosabban létezik egy másik hír a két említett szereplővel, de az, mint látni fogjuk, más, mint amiről a vezető magyar hírportálok “tudósítanak”.
Szóval az erszényes farkas és a Col2A1 gén esete a magyar elektronikus médiával, avagy fiktív hírek a nagyvilágból. Pontosabban létezik egy másik hír a két említett szereplővel, de az, mint látni fogjuk, más, mint amiről a vezető magyar hírportálok “tudósítanak”.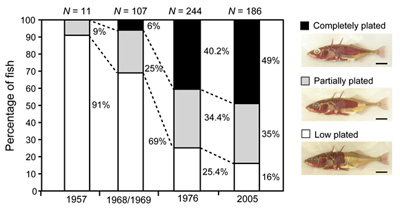 Az élőlények környezetének változásaira a természetes szelekció olyan génvariánsok (allélok) elterjesztésével reagál, amelyek az új körülmények között a legtöbbet nyújthatják hordozójuknak. És mivel a környezet folyamatosan változik, elvétve még az is előfordulhat, hogy hirtelen egy új és frissen elterjedt allél már nem előnyösebb, mint a gén régebbi verziója, sőt, s ilyenkor tanúi lehetünk egyfajta természetes “vissza az egész” procedúrának. Ezt a szaknyelv “reverz evolúciónak” nevezi és a közelmúltban a tüskés pikók egy populációjának esetében figyelték meg.
Az élőlények környezetének változásaira a természetes szelekció olyan génvariánsok (allélok) elterjesztésével reagál, amelyek az új körülmények között a legtöbbet nyújthatják hordozójuknak. És mivel a környezet folyamatosan változik, elvétve még az is előfordulhat, hogy hirtelen egy új és frissen elterjedt allél már nem előnyösebb, mint a gén régebbi verziója, sőt, s ilyenkor tanúi lehetünk egyfajta természetes “vissza az egész” procedúrának. Ezt a szaknyelv “reverz evolúciónak” nevezi és a közelmúltban a tüskés pikók egy populációjának esetében figyelték meg.
 A második világháború után, a japán frontról visszatérő
A második világháború után, a japán frontról visszatérő 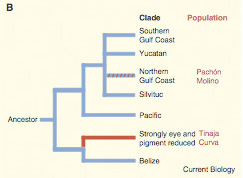 Az elvi részen túl persze még azt sem tudjuk pontosan, hogy az egyes halakban milyen mutáció okozza a szem elsorvadását, mindenesetre mivel számos vak Astyanax populáció nagyon távol él egymsától, feltételezhető, hogy a párhuzamos konvergens evolúció klasszikus példájával állunk szemben, vagyis a vakság egymástól függetlenül alakult ki. Ennek tesztelésére tökéletesen alkalmas a komplementáció, épp ezért végezte ezt el az NYU egyik kutatója, Richard Borowsky.
Az elvi részen túl persze még azt sem tudjuk pontosan, hogy az egyes halakban milyen mutáció okozza a szem elsorvadását, mindenesetre mivel számos vak Astyanax populáció nagyon távol él egymsától, feltételezhető, hogy a párhuzamos konvergens evolúció klasszikus példájával állunk szemben, vagyis a vakság egymástól függetlenül alakult ki. Ennek tesztelésére tökéletesen alkalmas a komplementáció, épp ezért végezte ezt el az NYU egyik kutatója, Richard Borowsky.