Az index.hu Tudomány rovatában ma reggel megjelent egy aprócska hír, mely szerint a Maastrichti Egyetem egyik kutatója, Mark Post petri-csészében növesztett marha izomsejtekből készül hamburgert készíteni. Ha ez nem molekuláris gasztronómia, akkor mi az? Tényleg, mi is az a molekuláris gasztronómia? Csak egy tudományoskodó hókuszpókusz, vagy tényleg köze van a molekuláris biológiához, kémiához?
Kalmár Éva bejegyzései
Kettős vagy négyes hélix?

Április 25-én volt pontosan hatvan éve, hogy James Watson és Francis Crick leközölte a Nature című folyóiratban a dezoxiribonukleinsav (DNS) általuk elképzelt szerkezetét [1]. A két kutató pálcikákból és lapokból álló modelleket készített kollégáik eredményei és elgondolásai alapján. Maurice Wilkins és Rosalind Franklin az 1950-es évek elején DNS szálakról készített nagy felbontású röntgendiffrakciós képei azt sugallták, hogy az spirál alakú és nem csak egy szálból áll. Alexander Todd szerves kémiai laboratóriumában 1952-ben kimutatták, hogy a dezoxiribonukleotidokat 3’-5’ foszfodiészter kötés tartja össze. Linus Pauling 1951-es alfa hélix fehérjeszerkezeti felfedezése alapján pedig William Cochran, Francis Crick és Vladimir Vand kidolgozott egy elméletet a hélix szerkezetű molekulák diffrakciójáról. Ezek alapján jutott el végül is Watson és Crick a már ismert kettős hélix modellig, mely sztereokémiailag a legmegfelelőbb választ adta arra, hogy a röntgendiffrakciós kép milyen szerkezetnek felelhet meg. A modell alapján két egymásnak ellentétes lefutású DNS szál kapcsolódik össze hidrogénkötésekkel, melyek a molekula belsejében található szerves bázisok között alakulnak ki. Az egymással szemben álló bázisok kapcsolódását pontosan a hidrogénkötések kialakulásának lehetősége szabja meg, az adenin csak a timinnel tud párban állni, míg a guanin a citozinnal. Ez a szerkezet igazolta Chargaff 1949-es eredményeit is, melyek szerint a DNS-ben a négyféle nukleotid nem egyforma arányban fordul elő [2]. Később, az in vitro előállított és kikristályosított DNS molekulák röntgendiffrakciója és egyéb fizikai mérése bebizonyította a modell helyességét, de rávilágított arra is, hogy ez csak egy a több lehetséges térszerkezet közül. A régi modellnek megfelelő DNS szerkezetet B-DNS-nek nevezték el, azóta kimutattak A- és Z-DNS-t is. Ezek szintén kettős hélix szerkezetűek, pár paraméterükben különböznek csak a hatvanéves modelltől.
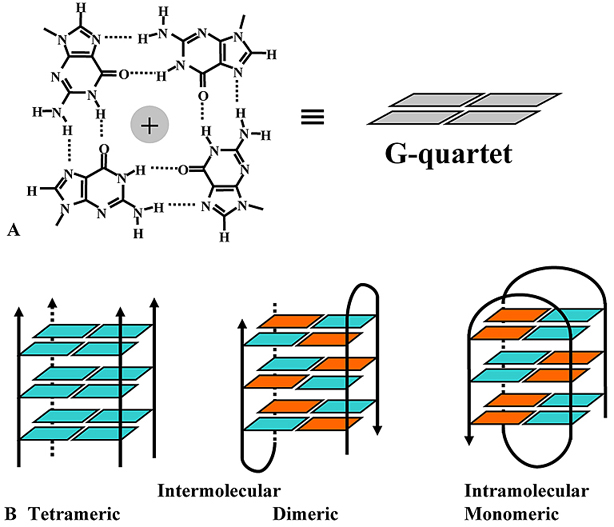
1962-ben, kilenc évvel a kettős hélix felfedezése után közölte le Gellert kollégáival a csak guaninból álló DNS-lánc általuk megfigyelt szerkezetét: a mesterségesen előállított DNS lánc röntgendiffrakciós képe négyes hélixet mutatott [3]. Később számos kísérlet igazolta a négyes hélix létét in vitro előállított DNS-szekvenciák esetén. Erre a speciális szerkezetre G-quadruplexként, G-tetrádként vagy G4-DNS-ként is hivatkoznak, pedig bármilyen nukleinsavban kialakulhat ez a szerkezet, nem DNS-specifikus. Négy guanin egy speciális, ún Hoogsteen hidrogénkötés kialakításával egy lapos struktúrát hoz létre, és ezek a guanintetrádokból álló síkok egymás fölé rendeződnek, így alakítva ki a G-quadruplex négyes hélixű szerkezetét. A tetrádokat kationok (általában kálium) stabilizálják. Attól függően, hogy hány molekula alkotja a négyes hélixet, három típus különböztethető meg, az intra-, a bi- illetve a tetramolekuláris, ezen kívül lehetnek parallel vagy antiparallel lefutásúak.
Sejtnyúlványok szállítják a hírvivő molekulákat egyik sejttől a másikig
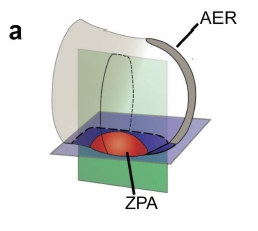 A gerincesek végtagfejlődésének egyik sokat kutatott lépése az ujjak kialakulása. A folyamatban fontos szerepet játszó sonic hedgehog (Shh) molekula a fejlődő végtagkezdemény egyik speciális, polarizációs zóna (ZPA– zone of polarizing activity) nevű régiójában expresszálódik. A ZPA mezenhimális sejtek kis csoportja a végtagbimbó poszterior részén, mely meghatározza a később keletkező ujjak számát és milyenségét. Hatását hosszú távon fejti ki, vagyis az apikális ektodermális redő (AER) sejtjei, melyek reagálnak a Shh-szignálra, nem közvetlenül a ZPA sejtek mellett helyezkednek el.
A gerincesek végtagfejlődésének egyik sokat kutatott lépése az ujjak kialakulása. A folyamatban fontos szerepet játszó sonic hedgehog (Shh) molekula a fejlődő végtagkezdemény egyik speciális, polarizációs zóna (ZPA– zone of polarizing activity) nevű régiójában expresszálódik. A ZPA mezenhimális sejtek kis csoportja a végtagbimbó poszterior részén, mely meghatározza a később keletkező ujjak számát és milyenségét. Hatását hosszú távon fejti ki, vagyis az apikális ektodermális redő (AER) sejtjei, melyek reagálnak a Shh-szignálra, nem közvetlenül a ZPA sejtek mellett helyezkednek el.
A ZPA-val és a Shh-gal kapcsolatban a hosszú táv más szempontból is fontos keresőszó. Ugyanis a ZRS enhanszer, az a reguláló elem, ami meghatározza, hogy a Shh a ZPA sejtjeiben termelődjön, magától a shh géntől több, mint 1Mb (1 millió bázispárnyi) távolságra van, méghozzá egy másik gén (lmbr1) intronjában [1]. Ráadásul a shh gén és a ZRS enhanszer között több funkcionális és az egyedfejlődés adott szakaszában nem aktív gén található. Érdekes módon a gének sorrendje és az enhanszer elhelyezkedése szinténiát mutat az ember, az egér és a fugu (Fugu rubripes) genomjában is. Sőt, mi több, az egérben azonosított cisz-reguláló elemmel homológ hal enhanszer transzgén egér embriókban képes volt rekapitulálni az eredeti shh expressziót a fejlődő végtagban [1]. Hogy pontosan hogyan fejti ki specifikus hatását az enhanszer ekkora távolságon, arra van pár elmélet és persze pár kísérletes válasz, ám a hosszú távú cisz-reguláció mechanizmusa pontosan még mindig nem tisztázott.
Visszatérve a jelátvitelre, a végtagfejlődésben is szerepet játszó szignaling molekulák egy része egy adott sejtcsoportban termelődik, hatásukat viszont ezektől viszonylag távol található sejtekben fejtik ki. A jelátvivők terjedésének mechanizmusára számos elmélet létezik, gerinceseknél főként a passzív diffúzió és a transzcitózisnak nevezett aktív transzport az elfogadott – ez utóbbi esetben a molekulákat az arra nem válaszoló szomszédos sejtek felveszik, majd továbbadják. Gerinctelen embriók esetében leírtak olyan mechanizmust, melyben speciális sejtnyúlványok (citonémák) szállítják az adott jelátvivőt a felhasználó sejtekig. A Nature online kiadványában vasárnap megjelent publikáció szerint a gerinces embriókban a Shh is hasonló sejtnyúlványokon keresztül jut el a célsejtekig [2].
Egy hangya karrierútja
A hangyák lenyűgözően fejlett szociális viselkedése régóta ámulatba ejti az őket tanulmányozókat. Az akár emberi léptékben is gigászi hangyabolyokat építő serény kis ízeltlábúak szociális viselkedését számtalanszor hozták párhuzamba az emberi társadalommal – gondoljunk csak a henyélő ciripelőket a fáradtságot nem ismerő, a télre gondosan felkészülő szorgos gyűjtögetőkkel szembeállító tanmesére.
Tavasszal szárnyas hangyaként hímek és nőstények százai röpülnek ki egy-egy bolyból. A párzás után nem sokkal a hím elpusztul, a nőstény elveszti szárnyait, és királynő lesz belőle. A csak nőivarú, steril utódokból különféle feladatokra szakosodott dolgozók lesznek; van, aki a petéket ápolja, van, aki takarít és a bolyt építi, van, aki a védelemre szakosodott és van, aki élelmet hoz. Amikor eljön a rajzás ideje, akkor keletkeznek csak hím illetve fogamzóképes nőstény egyedek, akik felnőve kirepülnek a bolyból.
A Lausanne-i  Egyetem kutatói ácshangyákat (Camponotus fellah) figyelnek meg már pár éve. A szaporodás után befogott nőstény szárnyas hangyák a kutatók által kifejlesztett környezetben hozták létre a kolóniákat. A konstans sötétben tartott mesterséges bolyban él a királynő a dolgozókkal, míg élelemért a beszerzők egy kis alagúton át juthatnak el a föld feletti világot szimuláló (fény-sötétség ciklussal rendelkező) részbe, ahol a táplálékot találják. A felnőtt állatokat egyedi kódokkal látták el, majd kamerával 41 napon át detektálták az immár négy éves, kb kétszáz tagból álló kolóniák tagjainak mozgását és az egyedek közti interakciókat. Mivel a kód alapján minden egyes felnőtt egyedet be tudtak azonosítani, a hangyakutatás története során először adódott arra lehetőség, hogy egy hangya, mint individuum karrierútját rögzítsék.
Egyetem kutatói ácshangyákat (Camponotus fellah) figyelnek meg már pár éve. A szaporodás után befogott nőstény szárnyas hangyák a kutatók által kifejlesztett környezetben hozták létre a kolóniákat. A konstans sötétben tartott mesterséges bolyban él a királynő a dolgozókkal, míg élelemért a beszerzők egy kis alagúton át juthatnak el a föld feletti világot szimuláló (fény-sötétség ciklussal rendelkező) részbe, ahol a táplálékot találják. A felnőtt állatokat egyedi kódokkal látták el, majd kamerával 41 napon át detektálták az immár négy éves, kb kétszáz tagból álló kolóniák tagjainak mozgását és az egyedek közti interakciókat. Mivel a kód alapján minden egyes felnőtt egyedet be tudtak azonosítani, a hangyakutatás története során először adódott arra lehetőség, hogy egy hangya, mint individuum karrierútját rögzítsék.
Probiotikumok kontra béltartalomtranszfer
Az Európai Tanács 2006-ban fogalmazta meg a 1924/2006/EK rendeletét, mely – többek között – kimondja, hogy az élelmiszereknek és táplálékkiegészítőknek is a gyógyszerekhez hasonló bizonyítási procedúrán kell átesniük, ha valamilyen feltételezett pozitív egészségügyi hatással bírnak.
„(13) Az egyes tagállamokban az élelmiszerek címkézésekor és reklámozása során számos olyan, jelenleg is alkalmazott állítás használatos, amelyek olyan anyagokkal kapcsolatosak, amelyek kedvező volta nem igazolt, vagy amelyeket illetően pillanatnyilag nincsen kellő tudományos egyetértés. Biztosítani kell, hogy az anyag, amelyre az állítás vonatkozik, valóban rendelkezzen kedvező táplálkozási vagy élettani hatással.”
„(22) Az egészségre vonatkozó állítások használatát csak a lehető legmagasabb színvonalú tudományos értékelést követően lehet engedélyezni a Közösségben. Ezen állítások összehangolt tudományos értékelése érdekében az Európai Élelmiszer-biztonsági Hatóságnak kell elvégeznie ezeket az értékeléseket.”
E rendeletre hivatkozva utasított el az Eu rópai Élelmiszer-biztonsági Hatóság (EFSA) 2012. decemberéig mintegy 1500 kérelmet, így ezen termékek csomagolásán nem tüntethető fel többé a probiotikus jelző (224 termék kapott rá engedélyt). Vagyis mostantól az EU-ban bizonyítani is kell, hogy egy adott termék olyan élő mikrobákat tartalmaz, amelyek kedvező hatással vannak az azt megfelelő mennyiségben fogyasztó egészségére, nem lehet csak úgy ráírni egy pohár joghurtra vagy egy kapszulás üvegre, hogy ha ezt isszuk-esszük, megedződik az immunrendszerünk, nem leszünk többé asztmások, rendbe jön a bélflóránk, esetleg elmúlik a depressziónk.
rópai Élelmiszer-biztonsági Hatóság (EFSA) 2012. decemberéig mintegy 1500 kérelmet, így ezen termékek csomagolásán nem tüntethető fel többé a probiotikus jelző (224 termék kapott rá engedélyt). Vagyis mostantól az EU-ban bizonyítani is kell, hogy egy adott termék olyan élő mikrobákat tartalmaz, amelyek kedvező hatással vannak az azt megfelelő mennyiségben fogyasztó egészségére, nem lehet csak úgy ráírni egy pohár joghurtra vagy egy kapszulás üvegre, hogy ha ezt isszuk-esszük, megedződik az immunrendszerünk, nem leszünk többé asztmások, rendbe jön a bélflóránk, esetleg elmúlik a depressziónk.
Na de mi a baj a probiotikumokkal? És vajon miért szentel a Nature Biotechnology idei 4. száma jó néhány összefoglaló, elemző cikket a probiotikumok és a humán bélflóra témájának?
A vak halak mikor alszanak?
 Azt hiszem az senkinek nem mond újat, hogy a kevés alvás negatív hatással van a szervezetre. Azon kívül, hogy a koncentrációs készség és az éberség csökken, a hosszú távú kialvatlanságnak komoly fiziológiai következményei is lehetnek; nagyobb eséllyel alakul ki elhízás, cukorbetegség, szív- és érrendszeri megbetegedés, és úgy átlagban nő a halálozási arány a krónikusan keveset alvók között – márpedig a CDC szerint az amerikaiak nagy többsége rendszeresen napi 6 óránál kevesebb alszik, ami már kimeríti a fenti kategóriát [1].
Azt hiszem az senkinek nem mond újat, hogy a kevés alvás negatív hatással van a szervezetre. Azon kívül, hogy a koncentrációs készség és az éberség csökken, a hosszú távú kialvatlanságnak komoly fiziológiai következményei is lehetnek; nagyobb eséllyel alakul ki elhízás, cukorbetegség, szív- és érrendszeri megbetegedés, és úgy átlagban nő a halálozási arány a krónikusan keveset alvók között – márpedig a CDC szerint az amerikaiak nagy többsége rendszeresen napi 6 óránál kevesebb alszik, ami már kimeríti a fenti kategóriát [1].
Ha belelátnánk a fejébe…
Nem is tudom, mit mondjak, ez a videó valami hihetetlen.
Egy élő zebrahal lárva fejébe látunk éppen felülről és oldalról, egy ún. high-speed light sheet mikroszkóppal. A transzgén hal egy olyan kalcium indikátor fehérjét termel (GCaMP5G), mely fluoreszcensen világít, amikor a neuron aktív. A videón az élő állat háromdimenziós agyműködését láthatjuk élőben, sejtszintű felbontásban, ahogy az aktív idegsejtek átadják egymásnak az ingerületet, ahogy az agy egyes részeire, majd a gerincvelőbe fut az információ.
Hihetetlen.
Nézzétek. A többi videót is.
Hogyan aktiválódik a telomeráz a rákos sejtekben?
 Egy felnőtt ember normál testi sejtje csak meghatározott számú osztódásra képes. A kromoszómavégeken a DNS másolását végző enzimrendszer ugyanis nem képes hatékonyan működni (a jelenség hátteréről bővebben e régebbi posztban lehet olvasni), és mivel minden egyes sejtosztódás előtt a sejt DNS-állománya megkettőződik, a kromoszómák vége így minden egyes osztódás után egyre rövidebb lesz. Amikor az itt található telomér regió kb 50 osztódás után elér egy kritikus hosszt, az kivált egy specifikus reakciót (DDR – DNA damage response) a sejtekben. E folyamat eredményeként a sejt megáll a sejtciklus G1/S ellenőrzőpontján és nyugvó állapotba kerül, amiből semmilyen stimulus vagy növekedési faktor nem tudja kibillenteni. Ezt az állapotot hívják replikatív szeneszcenciának.
Egy felnőtt ember normál testi sejtje csak meghatározott számú osztódásra képes. A kromoszómavégeken a DNS másolását végző enzimrendszer ugyanis nem képes hatékonyan működni (a jelenség hátteréről bővebben e régebbi posztban lehet olvasni), és mivel minden egyes sejtosztódás előtt a sejt DNS-állománya megkettőződik, a kromoszómák vége így minden egyes osztódás után egyre rövidebb lesz. Amikor az itt található telomér regió kb 50 osztódás után elér egy kritikus hosszt, az kivált egy specifikus reakciót (DDR – DNA damage response) a sejtekben. E folyamat eredményeként a sejt megáll a sejtciklus G1/S ellenőrzőpontján és nyugvó állapotba kerül, amiből semmilyen stimulus vagy növekedési faktor nem tudja kibillenteni. Ezt az állapotot hívják replikatív szeneszcenciának.
A leprás őssejtek
Ki ne hallott volna már az őssejtekről? Etikai kérdések központi témái, a média időről időre kerít valami izgalmas őssejtes hírt, az internet teli a köldökzsinórvérbankok és a gyógyíthatatlannak tartott betegségeket őssejtterápiával kezelő magánklinikák hirdetéseivel. Hovatovább, manapság már az öregedés elleni harc tuti befutói is lettek, mióta kiderült, hogy az embrionális őssejtekkel kezelt idős egerek háromszor hosszabb ideig élnek, mint a kezeletlen társaik [1]. De a legbizarrabb, szöveti sejteket őssejtekké újraprogramozó és azokat a maga önös érdekeire felhasználó élőlény mégsem az ember, hanem a leprát okozó Mycobacterium leprae.
 A jellegzetes végtagveszteséggel és az arc torzulásával járó betegség már az ókori Egyiptomban is szedte áldozatait, Európába első ízben Nagy Sándor “telepítette be” indiai hadjáratából visszatérve. Az ókorban és a középkorban örökletes betegségnek, átoknak vagy éppen büntetésnek vélték, a leprajárványok kezelése ennek megfelelően a különösen hatékony elkülönítés és megbélyegzés volt [2]. Aki azonban azt gondolná, hogy a lepra a letűnt idők betegsége, igencsak téved. A betegséget okozó, a tuberkulózis kórokozójával rokon baktériumokat 1873-ban fedezte fel Hansen, ám kezelésképpen még vagy hatvan évig legfeljebb a bőrolajfa (Hydnocarpus kurzii) olaját fecskendezték több-kevesebb sikerrel a leprás betegek bőre alá. 1950 óta alkalmazzák a dapszon nevű antibiotikumot a lepra terjedésének megállítására (nem sokkal később jelentek meg a dapszon-rezisztens Mycobacteriumok [3]), és 1990 óta 14 millió leprás beteget kezeltek világszerte. A betegség ellen folytatott ádáz küzdelemnek és a többféle antibiotikumból (dapszon, rifampicin és clofazimin) álló terápiának köszönhetően 2011-ben már “csak” közel 200 ezer új leprás fertőzést regisztrált a WHO [2].
A jellegzetes végtagveszteséggel és az arc torzulásával járó betegség már az ókori Egyiptomban is szedte áldozatait, Európába első ízben Nagy Sándor “telepítette be” indiai hadjáratából visszatérve. Az ókorban és a középkorban örökletes betegségnek, átoknak vagy éppen büntetésnek vélték, a leprajárványok kezelése ennek megfelelően a különösen hatékony elkülönítés és megbélyegzés volt [2]. Aki azonban azt gondolná, hogy a lepra a letűnt idők betegsége, igencsak téved. A betegséget okozó, a tuberkulózis kórokozójával rokon baktériumokat 1873-ban fedezte fel Hansen, ám kezelésképpen még vagy hatvan évig legfeljebb a bőrolajfa (Hydnocarpus kurzii) olaját fecskendezték több-kevesebb sikerrel a leprás betegek bőre alá. 1950 óta alkalmazzák a dapszon nevű antibiotikumot a lepra terjedésének megállítására (nem sokkal később jelentek meg a dapszon-rezisztens Mycobacteriumok [3]), és 1990 óta 14 millió leprás beteget kezeltek világszerte. A betegség ellen folytatott ádáz küzdelemnek és a többféle antibiotikumból (dapszon, rifampicin és clofazimin) álló terápiának köszönhetően 2011-ben már “csak” közel 200 ezer új leprás fertőzést regisztrált a WHO [2].
Embriós briós?
 Tegnap este többek között az index.hu és az origo.hu is beszámolt arról, hogy Dr. Szabó Marcel, a jövő nemzedékek érdekeinek védelméért felelős ombudsmanhelyettes vizsgálatot indít Magyarországon, hogy kiderüljön, az élelmiszerek hány százaléka készül emberi embrionális sejtek felhasználásával.
Tegnap este többek között az index.hu és az origo.hu is beszámolt arról, hogy Dr. Szabó Marcel, a jövő nemzedékek érdekeinek védelméért felelős ombudsmanhelyettes vizsgálatot indít Magyarországon, hogy kiderüljön, az élelmiszerek hány százaléka készül emberi embrionális sejtek felhasználásával.
„Dr. Szabó Marcel, ombudsmanhelyettes azt mondta, az általa indított vizsgálat elsősorban fogyasztóvédelmi szempontokra támaszkodva a fogyasztói tudatosság erősítésére szolgál, amelynek végeredményeként akár olyan rendszert is el tud képzelni, hogy a termékek címkéjén szerepeljen az embrionális eredetre utaló jelzés.”
Az index cikke annyi logikai bukfencet és szakmai pontatlanságot tartalmaz(ott, azóta többször javították) a republikánus oklahomai kormányzótól származó, amerikai internetes oldalakról átvett összeesküvés-elmélet félreértés mellett, hogy talán megéri részletesebben foglalkozni a témával.
