 Azt hiszem az senkinek nem mond újat, hogy a kevés alvás negatív hatással van a szervezetre. Azon kívül, hogy a koncentrációs készség és az éberség csökken, a hosszú távú kialvatlanságnak komoly fiziológiai következményei is lehetnek; nagyobb eséllyel alakul ki elhízás, cukorbetegség, szív- és érrendszeri megbetegedés, és úgy átlagban nő a halálozási arány a krónikusan keveset alvók között – márpedig a CDC szerint az amerikaiak nagy többsége rendszeresen napi 6 óránál kevesebb alszik, ami már kimeríti a fenti kategóriát [1].
Azt hiszem az senkinek nem mond újat, hogy a kevés alvás negatív hatással van a szervezetre. Azon kívül, hogy a koncentrációs készség és az éberség csökken, a hosszú távú kialvatlanságnak komoly fiziológiai következményei is lehetnek; nagyobb eséllyel alakul ki elhízás, cukorbetegség, szív- és érrendszeri megbetegedés, és úgy átlagban nő a halálozási arány a krónikusan keveset alvók között – márpedig a CDC szerint az amerikaiak nagy többsége rendszeresen napi 6 óránál kevesebb alszik, ami már kimeríti a fenti kategóriát [1].
Hogy pontosan miért is van szükségünk az alvásra, még mindig nyitott kérdés. Az viszont biztos, hogy az alvás-ébrenléti ciklus az egyik legfontosabb a cirkadián ritmusok között. A körülbelül 24 órás periódusidővel ismétlődő ciklusok (mint például a vérnyomás, testhőmérséklet, valamint a hormonok és enzimek mennyiségének napi ingadozása) segítik az élőlények adaptációját a nappal és éjszaka váltakozásához. A prokarióta kék algáktól az emberig az élőlényekben létezik egy belső óra, ami a külső környezettől független cirkadián periodicitást biztosít, ami kvázi interpretálja a szerveknek, sejteknek, hogy mikor van nappal, és mikor van éjszaka. Teljes sötétségben, konstans körülmények között a belső óra „szabadon fut”, vagyis beáll egy nagyjából 23-25 órás ciklusra, ám a külső környezet zeitgeber-nek nevezett paraméterei képesek a periódusidőt finomhangolni.
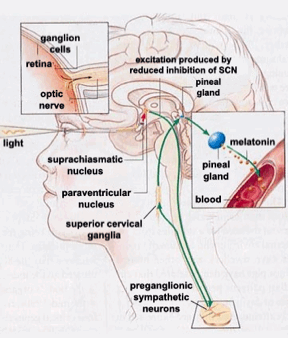
Gerincesekben az elsődleges belső órát a hipotalamusz szuprakiazmatikus magja (SCN, nucelus suprachiasmaticus) alkotja, ennek hiányában megszűnik mindenfajta cirkadián ritmus. Számos emberi szervről (mint pl a nyelőcső, a tüdő, a máj, lép, vese, csecsemőmirigy és bőr) kimutatták, hogy sejtjeik független cirkadián ritmust mutatnak, amelyeket a „mester”, az SCN hangol össze. Az SCN sejtjeiben a cirkadián ritmus irányításáért a periódikusan expresszálódó Clock (Clk) és Period2 (Per2) gének felelősek.Emlősök esetén a szemideg kereszteződése alatt található szuprakiazmatikus magba közvetlenül a szemből érkezik információ a retina melanopszint tartalmazó, fényérzékeny ganglion-sejtjeiből. A többi gerinces esetén a retinán kívül még az agy bizonyos régióiban (többek között a tobozmirigyben) is találhatók fényérzékeny sejtek, amelyekről valószínűsítik, hogy ugyanúgy részt vesznek a belső óra finomhangolásában.
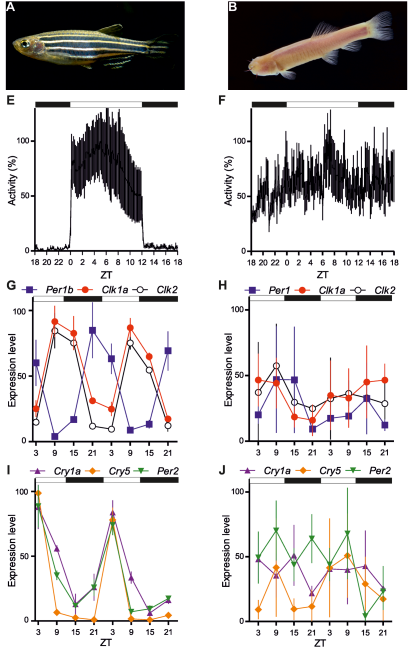
Nick Foulkes kutatócsoportja zebrahalon vizsgálja a cirkadián ritmusokat. Hogy kiderítsék, pontosan mi is az a mechanizmus, ami által a fény szinkronizálja a belső órát, egy olyan szomáliai barlangi halat hasonlítottak össze a zebrahallal, ami szintén a pontyfélékhez tartozik, ám pár millió barlangban töltött év alatt teljesen alkalmazkodott a sötétséghez. A B ábrán látható Phreatichthys andruzzii extrém troglomorf adaptációt mutat, nincsenek pikkelyei, pigmentálatlan a bőre és az egyedfejlődés korai stádiumában visszafejlődik a szem kezdeménye. Míg a felnőtt zebrahal a 12 óra fény – 12 óra sötétség (12-12 LD) kísérleti körülmények között jellegzetes napszakfüggő viselkedést mutatott (E ábra), a Phreatichthys viselkedése teljesen randomnak mutatkozott (F ábra). A fény és a belső óra által szabályozott gének (Per2, Cry1a, Cry5 illetve Clk1a, Clk2, Per1, Per1b) expresszióját felnőtt egyedekben, hal embriókban és izolált sejtekben vizsgálva ugyanilyen különbséget tapasztaltak a két halfaj között (G,H,I,J ábra), még az egyedfejlődés első napján is, mikor még a szem kezdeménye jelen van a később vakká váló halakban.
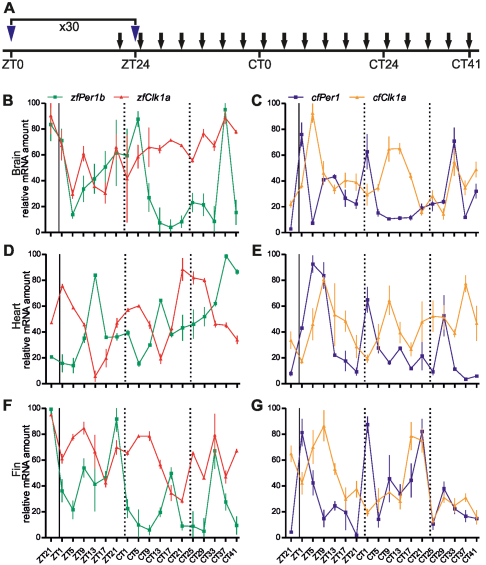
Az eredmények alapján nem volt igazán nyilvánvaló, hogy a barlangi halban maga a belső óra hiányzik, vagy csak nem fény által szinkronizálódik. Hogy ezt eldöntsék, egy gyakori alternatív zeitgeber, a táplálék periodikus megjelenésének hatását tesztelték: mindkét féle halat 30 napig konstans sötétségben tartva szigorú napirend szerint etették. Mind a zebrahal, mind a barlangi hal az etetési idő közeledtével aktívabb lett, úgynevezett táplálékváró magatartást (FAA, food anticipatory activity) mutatott. Molekuláris szinten vizsgálva a jelenséget, azt tapasztalták, hogy a clock és per géneket teljes sötétségben az élelem periódikus elérhetősége tudta szinkronizálni mind a zebrahalban (B, D és F ábra), mind a barlangi halban (C, E és G ábra).
Egy, a zebrahal per1b promóteréből és a luciferáz riportergénből álló konstrukciót a barlangi hal farokuszonyából létrehozott sejtenyészetbe (CF sejtek) transzformálva azt tapasztalták, hogy a dexametazon (glükokortikoid agonista) képes volt a luciferáz periodikus expresszióját biztosítani, ám az nem cirkadián, hanem infradián mintázatot mutatott, 24 helyett 43 óra periódusidővel. Mindez azt mutatja, hogy a barlangban élő vak Phreatichthys andruzzii rendelkezik ugyan belső órával, de az az átlagostól igencsak eltérő, ráadásul hőmérsékletfüggő és nem befolyásolható fénnyel. A szerzők ezután szisztematikusan ellenőrizték, hogy pontosan mi is az oka ez utóbbi jelenségnek. Végül arra a megállapításra jutottak, hogy a vak halakban termelődő fényérzékeny molekulák, névleg a melanopszin és TMT-opszin olyan mutációt tartalmaznak, amitől a fényérzékenységért felelős doménjük hiányzik, így konkrétan nem reagálnak a fényre (lenti ábra A része). Ha a zebrahal megfelelő fehérjéit is expresszáltatták a fenti riporter konstrukcióval a CF sejtekben, sikerült fényfüggő luciferáz aktivitást kapniuk (C és D) [2].
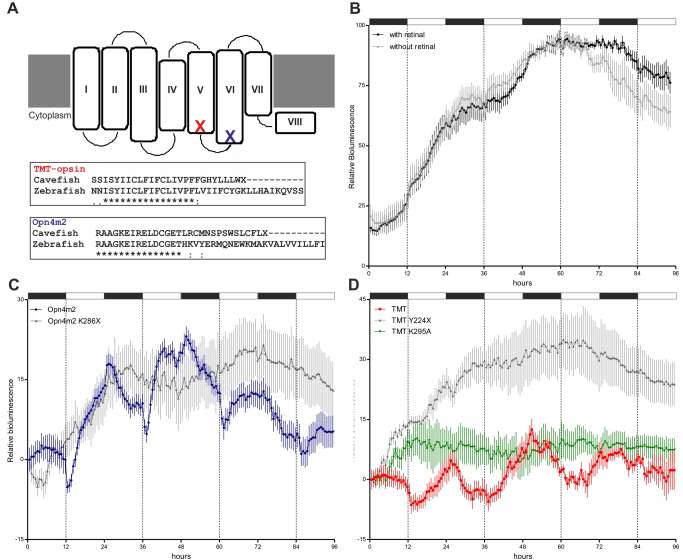
A kb 2 millió évnyi teljes sötétséghez és állandó hőmérsékleti viszonyokhoz való adaptálódása során a Phreatichthys andruzzii-ban a belső óra szokatlan tulajdonságokra tett szert: fény-szinkronizáció híján a periódusideje majdnem a kétszeresére nőtt, illetve elvesztette hőstabilitását. Az olyan mutációk, melyek a föld felszínén élőknél károsnak bizonyulnának, mint például a fényérzékeny molekulákat érintő stopmutációk, náluk semlegesek, így nem szelektálódtak ki az evolúció során. Az egyetlen változó tényező e barlangi halak életében valószínűleg a táplálék előfordulása, így nagy eséllyel evolúciós előnyük származik belőle, hogy a belső óra azzal szinkronizálható. Így hát a barlangi halak valószínűleg akkor alszanak, amikor éppen nincs mit enniük.
A 2. ábra forrása: http://thebrain.mcgill.ca
1. Moller-Levet, C.S., et al., Effects of insufficient sleep on circadian rhythmicity and expression amplitude of the
human blood transcriptome. Proc Natl Acad Sci U S A, 2013. 110(12): p. E1132-41.
2. Cavallari, N., et al., A blind circadian clock in cavefish reveals that opsins mediate peripheral clock photoreception.
PLoS Biol, 2011. 9(9): p. e1001142.
