
Ma nézzük meg egy kicsit közelebbről a baktériumok flagellumfehérjéinek exportját végző fehérjéket is, amelyek, mint tudjuk, még sokkal erősebb érvek az értelmes tervezés mellett, hiszen “Hiszen ahhoz, hogy egy ostor MÁSKÉNT alakuljon ki, mint jelenleg, a baktériumon belül működő rendkívül komplex mechanizmusnak is módosulnia kellene.” A kérdés az, tudunk –e erre példát mutatni?
Az FliI fehérje maga a transzportfehérje, amely átjuttatja a sejtmembránon a leendő flagellumot alkotó fehérjéket. Az FliH fehérje segíti az FliI fehérjekomplexhez kötését, hiányában nem működik hatékonyan a fehérjeexport, ám egyszersmind szabályozza is a működését. Ennek megfelelően az fliH gén deléciója után a baktériumsejt még valamennyire mozgásképes marad, az FliI fehérje hiánya azonban mozgásképtelen sejteket eredményezett.
Az ábrán a wt jelöli a vad típusú baktériumsejteket, látható, hogy messzire úsznak a leoltási ponttól, míg a ΔfliH és ΔfliI mutánsokból hiányzik az fliI és fliH gén, az első törzs egyedei valamennyire mozognak, a második törzs egyedei nem. A ΔfliHI –ből pedig mindkét gén hiányzik. Az ΔflhB pedig az flhB gén delécióját vagyis null mutánsát jelenti, ezek mozgásképtelenek.
Amikor kicsit jobban megvizsgálták ezeket a jószágokat, rájöttek, hogy ha a szokásos időtartam háromszorosán át hagyták a sejteket mozogni, akkor bizony azt a meglepő tényt fedezték fel, hogy ennyi idő alatt FliH fehérje hiányában a sejtek valamennyire elmozdultak a leoltási ponttól, az FliI fehérje hiányában egyáltalán nem, ám hogyha mindkét fehérjét kódoló gént deletálták, akkor mégiscsak mozogni kezdtek valamennyire ezek a sejtek. Vagyis az FliI fehérje hiányát valamennyire komplementálja, ha az FliH fehérje is hiányzik.
Egy kattintás ide a folytatáshoz…. →
 Új hónap, új meetup. Ezúttal október 20-án, a Tűzraktérben várunk este 7-től mindenkit szeretettel.
Új hónap, új meetup. Ezúttal október 20-án, a Tűzraktérben várunk este 7-től mindenkit szeretettel.

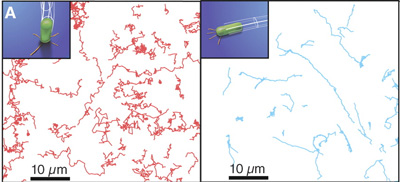 Bakteriális mozgás kapcsán leggyakrabban azokra az ostor által katalizált helyváltaztotásokra gondolunk, amelyeknek SexComb kolléga olyan
Bakteriális mozgás kapcsán leggyakrabban azokra az ostor által katalizált helyváltaztotásokra gondolunk, amelyeknek SexComb kolléga olyan  pilA mutánsok esetében nem jelentkezett, s ennek eredményeként ott a normális esetben megfigyelhető egyenletes biofilmek helyett, csomók keletkeztek.
pilA mutánsok esetében nem jelentkezett, s ennek eredményeként ott a normális esetben megfigyelhető egyenletes biofilmek helyett, csomók keletkeztek.
 A mexikói vaklazac (Astyanax mexicanus) mindig hálás téma, ha evo-devo témakörben írogatunk, most pedig a szokásost még egy kis viselkedés-biológiával is kiszínezhetjük.
A mexikói vaklazac (Astyanax mexicanus) mindig hálás téma, ha evo-devo témakörben írogatunk, most pedig a szokásost még egy kis viselkedés-biológiával is kiszínezhetjük.

 A “
A “