(Ez egy rendhagyó poszt, hiszen tulajdonképpen nem más, mint egy rettenetesen hosszú tudományos lábjegyzet a Cink-en megjelent életrajzhoz. Nem állítom, hogy önállóan nincs értelme, de mindenképpen ajánlanám a linkelt “anyaposzt” elolvasását. A “lábjegyzet” hosszát az is befolyásolta, hogy egy erős gimnáziumi biológia tudást mindenképpen feltételez az olvasó részéről – néha többet is, talán – de, ha a “Háború és békénél” rövidebbre akartam fogni a dolgot, másképp nem ment és így is igen terjedelmes lett.)
Ilyen-olyan módon, az ötvenes évektől kezdve Ullmann Ágnes kutatásai a génszabályozás és fehérjeszintézis különböző aspektusait feszegették, így talán a legjobban akkor tudok megágyazni későbbi mondanivalómnak, ha először tisztázzuk, hol is állt a tudomány az ötvenes években, amikor a mi történetünk tudományos vonzata is elkezdődik. Nincs is talán jobb bevezető, mint az éltrajzban is emlegetett 1957-es Crick előadás egy évvel később publikált átirata, amelyben kifejezetten élvezhető módon Francis Crick vázolja, hogy kb. hol tart a terület, melyek az igazán fontos kérdések, melyekre néha megdöbbentően pontos válaszokat ad (néha pedig ma már megmosolyogtatóakat, ugyanakkor ezeknek a szellemi üdesége mai szemmel is lenyűgöző).
Crick a fehérjeszintézisről
Ha visszamegyünk 1957-be, egy csomó minden, amit ma adottnak veszünk, ha a génexpresszió szabályozásáról beszélünk egyszerűen ismeretlen volt. Ugyan Beadle és Tatum már több mint tíz éve megfogalmazta “egy gén – egy enzim” tézisét, az még közel sem volt univerzálisan elfogadott, magyarán nem volt még teljes a konszenzus arról, hogy a DNS-en tényleg az egyes fehérjék aminosavsorrendje kódolódik-e, így a DNS mutációi aminosavsorrend cserét okozhatnak (pontosabban egyetlen biztos példa volt, a sarlósejtes vészegénység esetében a hemoglobin, de kérdés volt, hogy ez most kivétel, vagy szabály). Sőt, nem lehetett tudni, hogy összességében hány fajta aminosav vehet részt fehérjék kialaktásában, és még arról is viták voltak, hogy egy-egy fehérje aminosavsorrendje fix-e, vagy ha változó sorrendben, de ugyanolyan aminosavösszetétellel állítunk elő peptidláncokat, azoknak hasonló jellegük lesz-e (Crick például hosszan érvel amellett, hogy a fehérjeszerkezet az az aminosavsorrend függvényében jön létre, hiszen sokan nem így gondolták). Nem lehetett tudni, hogy az aminosavak miként aktiválódnak, mielőtt beépülnek a fehérjeláncba, a transfer RNS-ek (tRNS) léte csak feltételezve volt. Egy visszatérő problémának bizonyult egyébként, hogy a sejtben levő különböző RNS típusok – rRNS, tRNS, mRNS (hol vagyunk még ekkor a mikor RNS-ektől és társaiktól) – közti különbségek ismeretének hiányában, a teljes RNS mennyiséget egységes populációként vizsgálták, csak sejtések voltak, hogy lehetnek különböző RNS típusok. Így már voltak eredmények, amelyek “RNS tartalmú partikulumokat” kötöttek a fehérjeszintézishez (ezek bizonyultak később riboszómáknak) és az is egyre inkább bizonyosságot nyert, hogy nem csak az RNS jelenléte szükséges a sikeres fehérjeszintézishez, hanem bizonyos frakciójának a turnovere, vagy megújulása is (ez vezetett később a messenger RNS (mRNS) kimutatásához).
Crick egyik fontos meglátása, a ma is “centrális dogmaként” ismert tézis megfogalmazása, mely szerint az információáramlás a DNS-től a fehérjék fele egyirányú.

Ehhez kapcsolódik egy másik, legalább ennyire érdekes (ma már szintén triviálisnak számító) kérdés: ha elfogadjuk, hogy a DNS-en kódolódik az információ, akkor milyen módon történik mindez?
Nem Crickék voltak az elsők, akik ezzel a problémával birkóztak, pár évvel korábban már George Gamow is próbálkozott ilyesmivel. Gamow azt feltételezte, hogy bázis tripletek kódolják az aminosavakat, az egymás utáni tripletek viszont átfednek, illetve több mint egy triplet kódolhat egy-egy aminosavat, magyarán a kód degenerált.

Bár az első és utolsó feltételezése pontosnak bizonyult, Gamow elméletével egy komoly gond volt: az átfedések miatt erősen korlátozott lett, hogy egymás után milyen aminosavak következnek. Ez már 1957-re is világos volt, így Crick egy kézenfekvő változtatást javasolt: ne legyenek átfedőek a tripletek. Viszont érdekes módon Crick Gamow a kód degeneráltságára való javaslatát is elvetette, aminek következtében persze ismét felmerült, hogy miért nincs akkor 64 aminosav a fehérjékben (Crick 20 standard aminosavat posztulált, ami szintén meglepően pontosnak bizonyult). Az erre adandó választ Crick összekötötte azzal, hogy miképp döntheti el a sejt, hogy hol kell kezdenie a kód leolvasását (mai szakzsargonban, milyen frame-t használjon).
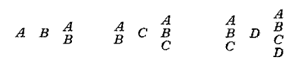 Érdekes módon, az evidens válasz, hogy van START és STOP kodon, nem fordult meg a fejében, hanem a genetika két másik legendás alakjával Frederick Griffithel és Leslie Orgellel egyetemben azt javasolták, hogy csak bizonyos tripletek kódoljanak aminosavakat, a többiek nem, így létrehozható pont húsz aminosav, úgy hogy az értelmes kódok közti átfedő tripletek értelmetlenek legyenek. (A mellékelt példán – ahol a négy bázist ABCD-vel jelölték – ABB vagy ABA megengedett triplet, míg a BAx alapú triplet (például) nem létezhetne.)
Érdekes módon, az evidens válasz, hogy van START és STOP kodon, nem fordult meg a fejében, hanem a genetika két másik legendás alakjával Frederick Griffithel és Leslie Orgellel egyetemben azt javasolták, hogy csak bizonyos tripletek kódoljanak aminosavakat, a többiek nem, így létrehozható pont húsz aminosav, úgy hogy az értelmes kódok közti átfedő tripletek értelmetlenek legyenek. (A mellékelt példán – ahol a négy bázist ABCD-vel jelölték – ABB vagy ABA megengedett triplet, míg a BAx alapú triplet (például) nem létezhetne.)
(Utólag visszanézve Gamow közelebb járt az igazsághoz de Crickék elméleti kódját még biztos fel lehet majd használni a szintetikus biológiában.)
Szökés előtt
Az Orvosi Vegytani Intézetben Straub Brúnó csoportjába kerülve Ullmann az aktin-polimerizációt kezdte tanulmányozni. 1949-ben Straub felfedezte, hogy az aktinhoz oligomer formában ATP-t köt, és a polimerizáció során ez ADP-vé bomlik és ennek a folyamatnak a részleteit kellett Ullmannak felderítenie. A spektrofotométerek kora előtt azonban nem volt triviális ATP koncentrációt mérni, így egy klasszikus, Szent-Györgyi Albert által kifejlesztett módszert használtak ennek elérésére: polimerizált akto-miozin gélt hoztak létre, ami ATP hatására depolimerizálódott, és a folyamat kinetikája (megfelelő kalibrálás után) alkalmas volt a kísérleti oldatok ATP koncentrációjának meghatározására. A munka során Ullmann ismerte fel először, hogy az aktinnak magának is lehet ATP-t bontó, ATPáz aktivitása, ami sok évvel később bizonyosságot is nyert.
Az aktinos munka, illetve a vörösvértestek membránjában levő ATPázok rövid tanulmányozása után Ullmann végül a fehérjeszintézis tanulmányozására kezdett koncentrálni. A kísérleti rendszerük a galamb hasnyálmirigy-metszetekben megfigyelhető amiláz szintézis lett. Radioaktíven jelölt glicint adva ehhez az in vitro rendszerhez, jól megfigyelhető volt a jelölt aminosav beépülése a fehérjébe. Ugyanakkor, azt is megfigyelték, hogy a jelölt aminosav hozzáadása, és a radioaktív jelet hordozó fehérjék megjelenése között bizonyos idő kellett elteljen, illetve a radioaktív fehérjék kialakulását RNS-t bontó enzimmel gátolni lehetett. Ebből, tulajdonképpen helytállóan, azt a következtetést vonták le, hogy a fehérjeszintézishez egy intermedier kell és a folyamatban szerepet játszik az RNS. (A csoport eredményeit Straub be is mutatta az ominózus londoni szimpóziumon és Crick is hivatkozik rá ’58-as cikkében.) Ez lett később Ullmann doktori értekezésének és első cikkeinek témája (a cikkek, egy kivételével, sajnos az online archívummal nem rendelkező Acta Physiologica Hungarica-ban jelentek meg).
Első párizsi útjából hazatérve Ullmann férje Erdős Tamás oldalán kamatoztatta a Francois Gros-tól eltanult molekuláris technikákat. Ennek a kollaborációnak két Nature cikk lett az eredménye, amely, ha figyelembe vesszük, hogy mindezt mindössze egyetlen év alatt érték el, egészen páratlan teljesítmény lenne ma is, de a korabeli magyar viszonyok közt mindenképpen az volt.
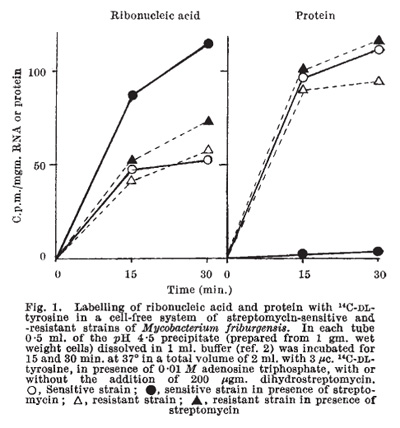 Erdős a Korányiban egy nem-patogén Mycobacterium fajjal (M. friburgiensis) dolgozott, amelynek streptomicin-szenzitív és -rezisztens törzseit egyaránt ismerték. Ekkor még nem lehet tudni, hogy ez az antibiotikum miként fejti ki a hatását, viszont Erdős törzsei és Ulmmann technikai ismeretei elegendőnek bizonyultak, hogy megfejtődjön a titok.
Erdős a Korányiban egy nem-patogén Mycobacterium fajjal (M. friburgiensis) dolgozott, amelynek streptomicin-szenzitív és -rezisztens törzseit egyaránt ismerték. Ekkor még nem lehet tudni, hogy ez az antibiotikum miként fejti ki a hatását, viszont Erdős törzsei és Ulmmann technikai ismeretei elegendőnek bizonyultak, hogy megfejtődjön a titok.
Radioaktívan jelölt tirozint adtak előbb in vitro rendszerhez (amit Gros protokollja alapján készítettek) és kimutatták, hogy ugyan az aminoacil-tRNS komplexek létrejönnek a streoptimicin-szenzitív baktériumokból készített extraktumokban is, az antibiotikum jelenlétében (ekkor persze még csak annyit tudtak, hogy van egy RNS frakció, amikapcsolódik az aminosavakhoz és fontos a fehérjeszintézi során), de a fehérje frakcióban már nem jelenik meg a jelölt tirozin ezen körülmények között. Magyarán a streptomicin specifikusan a fehérjeszintézist gátolja (ma már tudjuk hogy konkrétan a riboszóma megfelelő működését).
Második cikkükben aztán az in vitro rendszer eredményeit élő sejteken is sikeresen kimutatták, vagyis igazolták, hogy a baktériumok szaporodását a streptomicin a fehérjeszintézis gátlásán keresztül éri el.
A lac operon, ahogy abban az időben ismerték
A háború után a labormunkához visszatérő Jacques Monod folytatta korábbi munkáját, amely az egyes baktériumok cukorhasznosítási szokásait kutatta. Az általa is vizsgált Escherichia coli esetében is, a cukrok táplálékforrást jelentenek, de természetesen hasznosításukhoz először szükséges a feldogozásuk, ami a megfelelő enzimek segítségével történik. Ugyanakkor, egy baktérium számára fölösleges energia- és forráspocsékolás akkor is termeli bizonyos cukor-lebontó enzimeket, amikor a megfelelő cukormolekula nincs is jelen a közegben és ehhez kapcsolódott egy, a múlt század közepére már jól ismert jelenség, az ún. “enzimatikus adaptáció” (azaz, ha megjelenik egy cukor a környezetében, a baktérium sejt a megfelelő enzimek szintézisével “adaptálódik”).
A folyamatnak, mint azt Monodék felismerték, két elvi lehetséges magyarázata van: a cukor hatására egy aktivátor bekapcsolja a megfelelő enzimek működését, vagy egy addig aktív inhibitor gátlás alá kerül és a gátlás alól felszabadulva megindulhat az enzimek szintézise. Elsőre ugyan az előbbi magyarázat tűnne logikusabbnak, de Monodék kutatásai egyértelműsítették, hogy például az E. coli laktóz-hasznosítást lehetővé tevő enzimjei esetében az utóbbi logika a helytálló.
 A kutatások alapját a laktóz-hasznosítást nem megfelelő hatékonysággal végző mutánsok képezték, melyek segítségével először meg lehetett határozni, hogy hol helyezkednek el a baktérium kromoszómáján a laktóz-hasznosításban fontos enzimek, majd néhány ügyes genetikai trükk segítségével igazolni lehetett, hogy az enzimek szintézisét egy represszor molekula befolyásolja.
A kutatások alapját a laktóz-hasznosítást nem megfelelő hatékonysággal végző mutánsok képezték, melyek segítségével először meg lehetett határozni, hogy hol helyezkednek el a baktérium kromoszómáján a laktóz-hasznosításban fontos enzimek, majd néhány ügyes genetikai trükk segítségével igazolni lehetett, hogy az enzimek szintézisét egy represszor molekula befolyásolja.
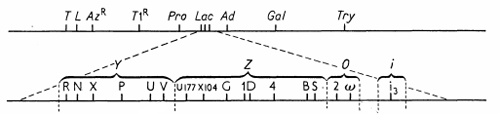
Az első felismerés az volt, hogy a laktóz sejtbe juttatásáért felelős permeáz enzimet kódoló genomi szakasz, és a laktóz bontásáért felelős β-galaktozidáz enzim egymás mellett helyezkedik el, és nem messze tőlük található a szintézisüket szabályozó i gén is.
Hogy a szabályozásra külön molekula létezik, arra először az utalt, hogy bár normális esetben a laktóz egyszerre indukálja a rendszert és lesz lebontandó szubsztrátja β-galaktozidáznak, később, mindenféle laktóz-analógokkal kísérletezve találtak olyanokat is, amelyek indukálják ugyan az enzimek szintézisét, de maguk nem bomlanak le. Ennél is meggyőzőbb bizonyítéknak bizonyult, egyúttal azt is igazolva, hogy a represszor jellegű szabályozóról van szó, az az hogy az i régióba eső mutációk hatására a rendszer konstitutívan aktívvá válik, magyarán akkor is termelődik mindkét enzim, ha a közegben nincs laktóz (vagy más laktóz-analóg).
A legmeggyőzőbb bizonyítékot arról, hogy az i lókusz terméke egy citoplazmatikus represszor azonban Monod munkásságának egyik legelegánsabb kísérlete szolgáltatta. A Pasteur intézetben vendégeskedő Arthur Pardee és Monod egyik közeli munkatársa, Francois Jacob segítségével lefolytatott kísérlet a szerzők alapján később PaJaMo (illetve “pajama”) kísérletként került be a kollektív tudományos emlékezetbe.
 Pardee, Jacob és Monod azt használták ki, hogy megfelelő körülmények között a baktérium sejtek rávehetők arra, hogy egymásnak genetikai anyagot adjanak. Ez a konjugáció jelensége, amikor a “hím sejtből” a kromoszóma átkerül a fogadó, “női sejtbe”, úgy hogy közben citoplazma nem adódik át (vagyis nem egyszerűen a két sejt valamilyen fúziójára kell gondolni). Mivel az, hogy a “hím” kromoszómából épp mennyi adódik át nagyban függ attól, hogy mennyi idő telt el (nem egyszerre kerül át, hanem előbb linearizálódik, majd mint egy madzag a lyukon, fokozatosan jut keresztül), el tudjuk azt is érni, hogy csak bizonyos részei adódjanak át, és a folyamatot le lehet állítani (praktikusa egy turmixgéppel, ami szétszedi az összetapadt sejteket).
Pardee, Jacob és Monod azt használták ki, hogy megfelelő körülmények között a baktérium sejtek rávehetők arra, hogy egymásnak genetikai anyagot adjanak. Ez a konjugáció jelensége, amikor a “hím sejtből” a kromoszóma átkerül a fogadó, “női sejtbe”, úgy hogy közben citoplazma nem adódik át (vagyis nem egyszerűen a két sejt valamilyen fúziójára kell gondolni). Mivel az, hogy a “hím” kromoszómából épp mennyi adódik át nagyban függ attól, hogy mennyi idő telt el (nem egyszerre kerül át, hanem előbb linearizálódik, majd mint egy madzag a lyukon, fokozatosan jut keresztül), el tudjuk azt is érni, hogy csak bizonyos részei adódjanak át, és a folyamatot le lehet állítani (praktikusa egy turmixgéppel, ami szétszedi az összetapadt sejteket).
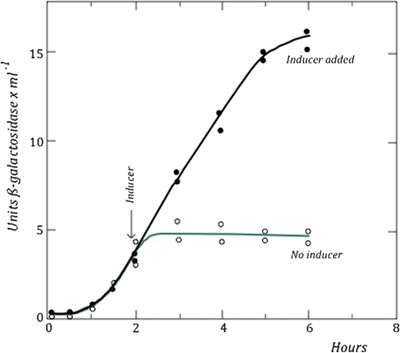
Amikor olyan befogadó sejteket használtak, melyek mind a galaktozidázban (z), mind a szabályozó régióban (i) mutációt hordoztak (z–i–) és vad-típusú DNS-t hordozó “hím” sejtekkel (z+i+) konjugáltatták őket, akkor azt figyelték meg, hogy előbb a z lókusz megy át és ennek megfelelően elindul a β-galaktozidáz szintézis, ami csak akkor áll le, amikor az i lókusz is átkerül. Az így létrejövő gátlás viszont feloldható, ha laktózt (vagy indukáló laktóz-analógot) adunk a rendszerhez. És ezt az eredményt sehogy másképp nem lehet magyarázni, csak azzal, hogy a rendszer szabályozott és egy gátolható represszor szabályozza. (Pontosabban, a történelmi hűség kedvéért, Monodék sokáig megpróbálták, hiszen a jelenséget egészen addig egyfajta indukciós lépésnek vélték, ahol egy faktor a laktóz hatására indukálja a lac operon génjeinek átírását. A “repressziós modell” fokozatos térnyerésében fontos szerepe volt – és itt egy másik magyar szál – a gyakran az intézetben vendégeskedő Szilárd Leónak, aki az elsők közt (ha nem konkrétan elsőként) ismerte fel, hogy itt egy represszióról lehet szó.)
Az E. coli laktóz-rendszere, illetve a Francois Jacob által tanulmányozott lambda-fág eredményeinek segítségével Monod és Jacob egy ma már klasszikusnak számító 1961-es cikkben jutott el annak a felismeréséhez, hogy a baktériumokban az egymással kapcsolatban levő folyamatokat katalizáló enzimek azért vannak fizikai közelségben is, mert egyetlen szabályozási egységhez, ún. operonhoz tartoznak.
 A felismerést, tegyük hozzá, az is segítette, hogy találtak olyan “operátor” (O) mutánsokat, amelyek nagyon közel voltak a Z lókuszhoz, de nem estek azért bele, viszont hatásukra a rendszer vad-típusú represszor jelenlétében is konstitutívan aktív lett. Ez, okoskodtak (mint ma már tudjuk, helyesen) Monodék azért lehet, mert ide köt a represszor, és ez által szabályozódik az operátor mögött levő enzimeket kódoló géneket.
A felismerést, tegyük hozzá, az is segítette, hogy találtak olyan “operátor” (O) mutánsokat, amelyek nagyon közel voltak a Z lókuszhoz, de nem estek azért bele, viszont hatásukra a rendszer vad-típusú represszor jelenlétében is konstitutívan aktív lett. Ez, okoskodtak (mint ma már tudjuk, helyesen) Monodék azért lehet, mert ide köt a represszor, és ez által szabályozódik az operátor mögött levő enzimeket kódoló géneket.
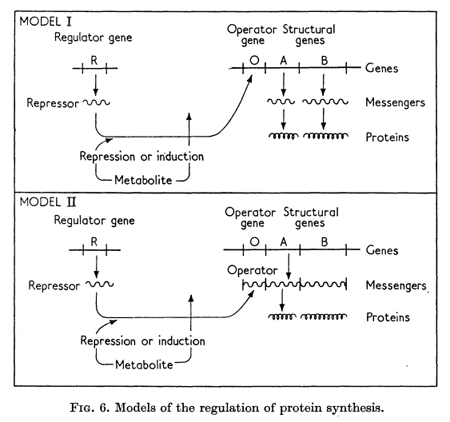
A két francia két modellt is javasolt az operon működésének magyarázatára (amiből aztán tulajdonképpen el is vetették a másodikat): az egyik szerint a represszor a DNS-hez köt, és így fejti ki hatását, a mögött elevő génekről egyenként készül egy köztes, rövid életidejű “hírvivő” (messenger) molekula, ami aztán a fehérjeszintézis alapjául szolgál. A másik esetében a teljes operonról egyetlen hosszú (szakzsargonban policisztronikus) messenger jönne létre és erről keletkeznének később az egyes fehérjék, de ezen hatna a represszor is.
Monodék az első modellel szimpatizáltak, de tulajdonképpen, ma már tudjuk, hogy a kettő közt van az igazság: bakteriális rendszerekben egy policisztonikus messenger keletkezik, de abba nem tartozik bele az operátor szekvenciája és utóbbihoz a DNS-en köt a represszor.
Aki éles szemű, felfedezhet egy másik hibát is a cikk ábráján, ami mindkét modellre igaz: egy korábbi eredmény félrevezette a szerzőket és azt gondolták, hogy a represszor RNS formában hat. Ez, ma már tudjuk, nem igaz, egy nagyon jól kristályosítható fehérjéről van szó.
De és talán e mellett se menjünk el említés nélkül, Jacob és Monod talán az elsők, akik ebben az írásukban nevesítik a “hírvivő” molekulát: mivel minden jel szerint ez egy RNS kell legyen, legyen messenger RNS, vagy mRNS.
Így állt tehát a fehérjeszintézis tudománya 1960 körül, amikor Monod Magyarországra látogatott az Akadémia meghívására. A kisebb hibák ellenére Monod és Jacob munkája ekkorra már tényleg valami nagyon-nagyon újat és fontosat tanított a génszabályozás mechanizmusáról, nem véletlen, hogy öt évvel később Nobel díjat kaptak. És ez az a pont, ahol a frissen emigrált Ullmann Ágnes is bekapcsolódott a Pasteur Intézet munkájába.
A lac operon represszora és promótere
Ullmann azonnal elkezdett dolgozni, amint Párizsba ért és első feladata az i lókusz által kódolt represszor izolálása volt. Mint az előbb említettem, ekkor még mindenki meg volt győződve, hogy ez egy RNS molekula kell legyen, ennek megfelelően a kísérletek is ennek az izolálására lettek tervezve: egy radioaktívan jelölt nem-lebomló laktóz analógot (C14-metil-tiogalaktozid – TMG) használtak az indukcióhoz és (feltételezve, hogy az RNS kapcsolódik ezzel) a radioaktívan jelölt RNS-eket vizsgálták. Ilyent viszonylag hamar leltek is, ám számtalan próbálkozás ellenére, ugyanez az RNS frakció mindig megjelent olyan mutáns baktréiumok vizsgálatakor is, amelyek a teljes lac régiót elvesztették. Később derült csak ki, hogy a TMG metil csoportokat adott az RNS-eknek, ezt detektálták a kísérleteikben, ami az egyik első (bár sajnos nem publikált) bizonyítéka lett az RNS-metilációnak.
Közben gyülekeztek a további bizonyítékok is, amelyek miatt egyre nyilvánvalóbb lett, hogy a represszor nem lehet RNS, hanem mégis fehérje, így a következő próbálkozás ennek az izolálása lett volna. Itt azonban szintén nem várt kudarcba futottak: a represszor nagyon potens és annyira kevés van ezért belőle a sejtekben, hogy a kor legszenzitívebb módszereivel sem tudtak értékelhető mennyiséget kitisztítani. Évekkel később aztán egy másik csoport úgy tudta áthidalni ezt a problémát, hogy olyan mutánsokat izoláltak, amelyek túltermelték a represszort, azonban ott és akkor Jacob nem tartotta valószínűnek, hogy ilyen mutánsok létezhetnek, így a Pasteurbeli csoport felhagyott a projekttel.
A következő munka már több sikerélményt tartogatott: Jacob és Monod operon-elméletét igazolandó, azt akarták kimutatni, hogy megfelelő deléciók izolálása esetén, közeli operonok azonos szabályozás alá eső “hibrid” operonokat hozhatnak létre.
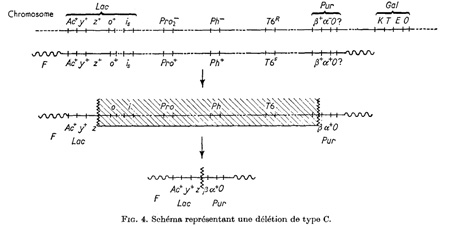 Ehhez a lac operon közelében elhelyezkedő, purin-szintézisért felelős pur operont használták fel, pontosabban azokat a mutánsokat, amelyekben, egy nagyméretű genomi deléció miatt a két régió összeolvadt.
Ehhez a lac operon közelében elhelyezkedő, purin-szintézisért felelős pur operont használták fel, pontosabban azokat a mutánsokat, amelyekben, egy nagyméretű genomi deléció miatt a két régió összeolvadt.
A pur operon által kódolt bioszintézis útvonalak szabályozásáért felelős enzimek sajátossága, hogy az ő “enzimatikus adaptációja” visszacsatoló-gátláson alapul és amikor elegendő lesz a szintetizált molekulából, akkor kikapcsolódik az operon (hogy ne termelődjön fölöslegesen a molekula). Az Ullmann és Jacob által izolált “hibrid” operonban ennek a szabályozásnak megfelelően a laktóz permeáz szintézise alap esetben (laktóz jelenlététől függetlenül) megfigyelhető volt, ám purinok jelenlétében lecsökkent – épp ahogy azt várnánk, ha a pur operátor régió szabályozása alá került.
A kísérlet, amely az in vivo gén-mérnökösködés egyik legelső példája is lett egyben, végérvényesen bebizonyította az operon elmélet létjogosultságát.
β-galaktozidáz komplementációk
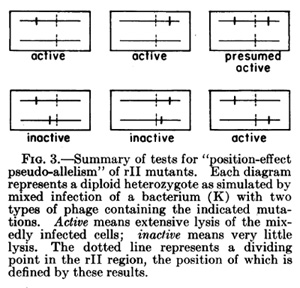 Seymour Benzer nagyhatású fág-komplementációs kísérletei nyomán sokáig uralkodó szemlélet volt a molekuláris biológiában, hogy ha egy sejten belül, ugyanazon fehérjeláncot kódoló DNS szegmensekben (amelyket Benzer cisztronnak nevezett) vannak különböző mutációk, azok “nem komplementálnak”, vagyis ha vagy egyik, vagy másik mutációt hordozó fággal egyszerre fertőzünk meg egy baktérium sejtet, akkor abból továbbra sem lesz fertőzőképes fág-utód (hiszen vagy az egyik, vagy a másik mutáció miatt, de csak nem képes a megfelelő fehérje termelődni). Ha azonban két, hasonló fenotípust mutató fág-mutánssal megfertőzve a baktériumot, működőképes fágot kapunk (szakzsargonban a mutációk komplementálnak), az aztj jelenti, hogy a mutációk különböző cisztronokban vannak, ezért, ebben a pszeudo-diploid állapotban vagy az egyik, vagy a másik fággenomról végül csak képződik a megfelelő fehérje.
Seymour Benzer nagyhatású fág-komplementációs kísérletei nyomán sokáig uralkodó szemlélet volt a molekuláris biológiában, hogy ha egy sejten belül, ugyanazon fehérjeláncot kódoló DNS szegmensekben (amelyket Benzer cisztronnak nevezett) vannak különböző mutációk, azok “nem komplementálnak”, vagyis ha vagy egyik, vagy másik mutációt hordozó fággal egyszerre fertőzünk meg egy baktérium sejtet, akkor abból továbbra sem lesz fertőzőképes fág-utód (hiszen vagy az egyik, vagy a másik mutáció miatt, de csak nem képes a megfelelő fehérje termelődni). Ha azonban két, hasonló fenotípust mutató fág-mutánssal megfertőzve a baktériumot, működőképes fágot kapunk (szakzsargonban a mutációk komplementálnak), az aztj jelenti, hogy a mutációk különböző cisztronokban vannak, ezért, ebben a pszeudo-diploid állapotban vagy az egyik, vagy a másik fággenomról végül csak képződik a megfelelő fehérje.
A komplementációs képesség alapján Benzer “komplementációs csoportokat” definiált (az A csoportban levő mutációk komplementálták a B csoportban levő mutációkat, de ugyanakkor sosem komplementáltak egymással), amelyeket végső soron egyenértékűnek tekintett a cisztronokkal.
Később derült csak ki, hogy ez az egyenértékűség nem mindig érvényes, több doménből álló fehérjékre gyakran döcög, és ennek felismerésében Ullmann β-galaktozidáz enzimen végzett vizsgálatai is nagyon fontosak voltak.
A β-galaktozidázt kódoló LacZ gén deléciós mutánsait vizsgálva Ullmann rájött, hogy amikor akkor is lát komplementációt, ha az egyik végben levő mutációkat, a gén másik végében levő mutációkkal keresztezi össze. Ez egy ideig meg is kavart mindenkit rendesen, hiszen a benzeri definíció alapján akkor több cisztonból kellett volna álljon a LacZ, nem csak egyből, ahogy addig gondolták, de később egyre inkább úgy tűnt (és, amikor évtizedekkjel később elkészült az enzim kristályszerkezete végleg bizonyossá vált) hogy ha a mutációk ez egyes fehérjék különböző doménjeibe esnek, akkor – ha a domének feltekeredése nem függ egymástól – létrejöhet működőképes enzim-multimer (alap esetben négy darab β-galaktozidáz alkot egy tetramer komplexet, és ebben zajlik a reakció).
Ezzel a módszerrel Ullmann előbb a ω-komplementáció jelenségét, illetve az N-terminális ω-fragmenst írta le, majd később következett a mára hatalmas karriert befutó α-komplementáció. Utóbbiban az a lényeg, hogy a fehérje elején (N-terminálisán) levő 60 aminosavat koexpresszálva egy, a 11-41. aminosavait nélkülöző LacZ mutánssal, funkcionális enzim-komplexhez jutunk, ami bontani képes a laktózt – vagy analógjait.
Ezt az egyszerű tulajdonságot használják ma is ki a legfontosabb klónozó-plazmidok, amelyekben azt, hogy az általunk sokszorosítani kívánt DNS darab (pl. PCR termék) bekerült-e vagy sem, az α-komplementáción alapuló “kék-fehér” szelekció révén tudjuk megmondani.
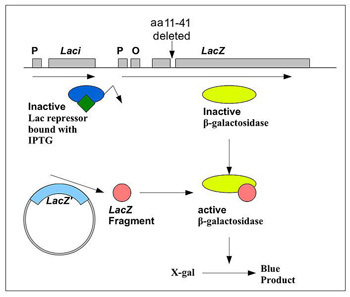 Röviden, a plazmidok sokszorosításához felhasznált laboratóriumi E. coli törzsek genomjában a Δ11-41 LacZ mutáció van (vagyis ezek a törzsek önmagukban nem termelnek működőképes β-galaktozidázt. A “gyári” plazmidvektorokban viszont ott van a α-peptid szekvenciája, így ha a plazmid bejut, akkor a sejt létre tudja majd hozni a funkcionális enzim-komplexeket, és ezt úgy láthatjuk, hogy egy szintetikus, színtelen, de hasítás után kék-csapadékot képező laktóz-analógot, az X-Gal-t adjuk a táptalajhoz. Ez a szelekció “kék” része. A “fehér” pedig abból ered, hogy ezek a klónozó plazmidok, pont az α-peptid-be építik bele az általunk sokszorosítani akart szekvenciát, és ha ez sikeres, akkor az α-peptid peptid értelemszerűen már nem termelődik, így a baktériumok sem tudják majd az X-Galt bontani, a felnövő telepek nem kékülnek be. (Megj.: mivel a plazmidokon antibiotikum-rezisztencia gének is vannak, megfelelő antibiotikum táptalajba keverésével elérhető, hogy csak eleve azok a baktériumok nőjjenek fel, akik felvették a plazmidot.)
Röviden, a plazmidok sokszorosításához felhasznált laboratóriumi E. coli törzsek genomjában a Δ11-41 LacZ mutáció van (vagyis ezek a törzsek önmagukban nem termelnek működőképes β-galaktozidázt. A “gyári” plazmidvektorokban viszont ott van a α-peptid szekvenciája, így ha a plazmid bejut, akkor a sejt létre tudja majd hozni a funkcionális enzim-komplexeket, és ezt úgy láthatjuk, hogy egy szintetikus, színtelen, de hasítás után kék-csapadékot képező laktóz-analógot, az X-Gal-t adjuk a táptalajhoz. Ez a szelekció “kék” része. A “fehér” pedig abból ered, hogy ezek a klónozó plazmidok, pont az α-peptid-be építik bele az általunk sokszorosítani akart szekvenciát, és ha ez sikeres, akkor az α-peptid peptid értelemszerűen már nem termelődik, így a baktériumok sem tudják majd az X-Galt bontani, a felnövő telepek nem kékülnek be. (Megj.: mivel a plazmidokon antibiotikum-rezisztencia gének is vannak, megfelelő antibiotikum táptalajba keverésével elérhető, hogy csak eleve azok a baktériumok nőjjenek fel, akik felvették a plazmidot.)
Nem ez lett az egyetlen biotechnológiai vonatkozása Ullmann munkájának. Kihasználva a β-galaktozidáz és egyik inhibitora közti nagy affinitású kapcsolatot, egy olyan rendszert is létrehozott, ahol egy oszlopra kötött inhibitor segítségével nagy tisztaságú hibrid fehérjéket volt képes tisztítani olyan törzsekből, amelyekben valamilyen genetikai trükkel összekpacsolták a β-galaktozidázt egy másik fehérjével, vagy annak egy darabjával. (Ez azért lehetséges, mert a β-galaktozidáz az első 23 aminosava nélkül is működőképes, azaz megköti az inhibitorát.) A ma elterjedt polihisztidinjel-alapú affinitás kromatográfia előtt ez volt a legjobb módszer fehérjetisztításra.
A katabolit represszió
 Ullmann számos fontos felismerése közül az egyik legfontosabb pont a Jacob és Monod által leírt szabályozási rendszer finomítása lett.
Ullmann számos fontos felismerése közül az egyik legfontosabb pont a Jacob és Monod által leírt szabályozási rendszer finomítása lett.
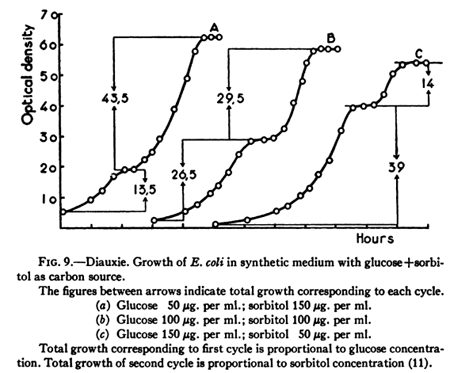
Monod már korábban felismerte, hogy a glükózon és másfajta cukrokon növekvő E. coli tenyészetek esetében a növekedési görbe jellegzetes kettősséget mutat, ahol a növekedési görbe első fázisa a glükót koncentrációval arányos, a második pedig a másik cukoréval (ez volt, Monod elnevézésével élve, a diauxie).
Az egész jelenség olyan volt, mintha a baktérium előbb elhasználná a rendelkezésére álló glükózt és csak ezután kapcsolná be a másik cukor elbontására alkalmas enzimjeit. Más szóval a glükóz jelenléte mintegy gátolta a többi enzim termelését – ez lett a katabolit represszió jelensége.
Ulmann eredetileg a kisméretű, ciklikus adenozin-monofoszfát (cAMP) molekula hatását akarta baktériumokban tanulmányozni. Az érdeklődés részben abból eredt, hogy Monod közben egyre jobban elkezdett érdeklődni a fehérjék funkciójának alloszterikus szabályozása iránt, amire remek példát szolgáltatott például az eukarióta glikogén-foszforiláz működése, amelynek a különböző állapotai közti váltás cAMP függvényében következett be. Az allosztéria jelensége aztán egyre inkább a bűvöletébe kerítette az ekkor már Nobel díjas tudóst, olyannyira, hogy lassan mindenütt ezt vélte felfedezni. Egy belső szemináriumra készülve, Ullmann az ördög ügyvédjét játszva, arra akarta felhívni a figyelmet, hogy a cAMP számos más folyamtban is szerepet játszhat (pl. másodlagos hírvivő molekulaként egyes jelátviteli kaszkádokban), amikor felfigyelt arra, hogy egy friss kutatás szerint cAMP jelen van baktériumokban is.
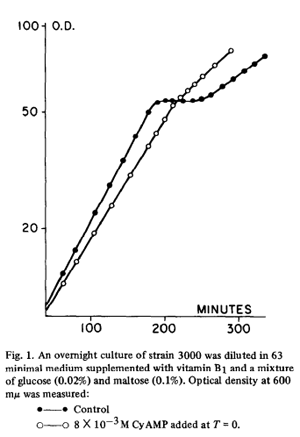 Ugyan a közeli munkatársai megpróbálták lebeszélni, Ullmann mégis belefogott a cAMP hatásának vizsgálatába és szinte rögtön megdöbbentő eredményeket kapott. Ezek közül a legmeglepőbb, hogy cAMP jelenlétében megszűnik a növekedési görbe diauxie jellege, azaz eltűnik a katabolit represszió, a rendszer “derepresszálódik”.
Ugyan a közeli munkatársai megpróbálták lebeszélni, Ullmann mégis belefogott a cAMP hatásának vizsgálatába és szinte rögtön megdöbbentő eredményeket kapott. Ezek közül a legmeglepőbb, hogy cAMP jelenlétében megszűnik a növekedési görbe diauxie jellege, azaz eltűnik a katabolit represszió, a rendszer “derepresszálódik”.
A következő évek arról (is) szóltak, hogy ezt a derepresszálási jelenséget megértsék és ennek az eredményeként izolálták egy katabolit moduláló faktort (eredetlieg CMF rövidítéssel futott, de mára már inkább CAP néven ismerjük).
Ez az a faktor, ami alapesetben kikapcsolva tartja az “egyéb” cukor-operonokat (így a lac operont is), míg a glükóz el nem fogyott a közegből. Ilyenkor a cAMP mint belső, “éhezési” szignál jelent meg a sejtben, koncentrációja növekedni kezd, és ennek hatására a CAP-mediált represszió megszűnik. A cAMP kötés-hatására a CAP szerkezetváltozáson megy át, a cAMP-CAP komplex pedig már képes lesz a DNS-hez kötődni és ezáltal elősegíteni a transzkripciót végző RNS polimeráz kapcsolódását is. Így, ha van megfelelő cukor a közegben, akkor a releváns metabolikus enzimek szintézise bekapcsolt (hiszen a represszorok már nem tesznek keresztbe a polimeráz munkájának).
Ez a rendszer lett aztán az, amivel ma is találkozhtaunk a tankönyvekben, jegyzetekben, ha a lac operon komplex szabályozásáról beszélünk. És paradox módon, ugyan az egész sztori abból indult ki, hogy Ullmann a cAMP nem allosztéria-specifikus hatásait akarta összeszedni egy előadás erejéig, végül mégis egy olyan rendszert fedezett fel és írt le, ami mindennél jobban példázza ennek a kis molekulának a fehérjék szerkezetére gyakorolt hatását.
Az adenilát-cikláz és patogének
 Monod halála után, karreirje utolsó szakaszában Ullmann, továbbra is a cAMP molekula bakteriális funkcióit vizsgálva, a patogén mikróbák adenilát-cikláz (CyA) enzimjét kezdte vizsgálni. A CyA hozza létre a cAMP-t, ugyanakkor, patogénekben nagyon más funkciót tölt be, mint a korábban már viszonylag jól jellemzett E. coli-ban.
Monod halála után, karreirje utolsó szakaszában Ullmann, továbbra is a cAMP molekula bakteriális funkcióit vizsgálva, a patogén mikróbák adenilát-cikláz (CyA) enzimjét kezdte vizsgálni. A CyA hozza létre a cAMP-t, ugyanakkor, patogénekben nagyon más funkciót tölt be, mint a korábban már viszonylag jól jellemzett E. coli-ban.
A modellként választott Bortadella pertussis (a szamárköhögés kórokozója) esetében az adenilát cikláz toxinként működik, ami nem a bakteriális sejtben fejti ki a hatását, hanem a patogén kiválasztja, majd a gazdaszervezet sejtjeibe kerül, ahol felborítja a teljes sejten belüli kommunikációt (hiszen az általa létrehozott cAMP egyben egy másodlagos hírvivő a sejtben, így ha hirtelen túltermelődik, az kaotikus állapotokat hoz létre a sejtben).
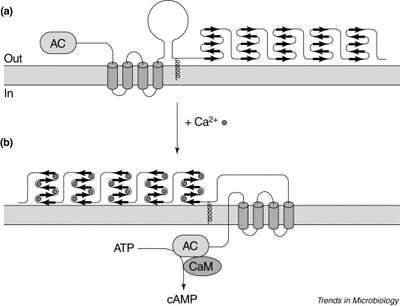
Ezen kívül a B. pertussis CyaA enzim sajátossága, hogy csak az egyik végén levő domén felelős az adenilát-cikláz aktivitásért, a fehérje nagyobb (kb. kétharmad része) hemolizin aktivitású, és az egyik fontos funkciója az, hogy megfelelő ingerek esetében (pl. kálcium szint növekedése) segítse az adenilát cikláz (AC) domént bejutni a sejtbe.
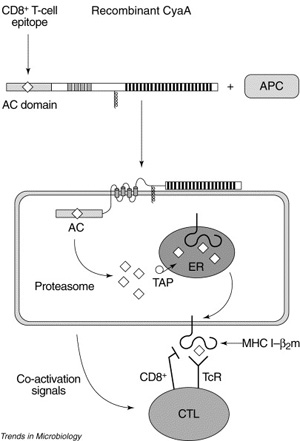 Ullmann csoportjának fontos eredményei voltak a CyA fehérje izolálásában és jellemzésében, de arra is rájöttek, hogy a fehérje különleges képességét (hogy egy doménjét bejuttatja a gazdasejtbe) fel lehet használni vakcinakészítés során.
Ullmann csoportjának fontos eredményei voltak a CyA fehérje izolálásában és jellemzésében, de arra is rájöttek, hogy a fehérje különleges képességét (hogy egy doménjét bejuttatja a gazdasejtbe) fel lehet használni vakcinakészítés során.
Ehhez arra van szükség, hogy egyrészt az AC domén katalitikusan inkativálva legyen (hogy ne okozzon káoszt a sejtben), illetve, valahogy ebbe a doménbe olyan peptiddarabokat juttassunk, amelyek a sejtek belső rendszerében feldolgozva a sejtfelszínre kerülve “bemutatódnak” az immunsejteknek, így azok meg tudják “tanulni” felismerni ezt az idegen epitopot, s így később, valódi fertőzés esetében hatékonyabb immunválaszt képesek mutatni. Például különböző vírusokból származó eptopokkal így “immunizálva” elérhető, hogy később, a kezelt egerek kevésbé betegedjenek meg, amikor valódi vírusfertőzés következik be.
A rendszer azonban vírus-védelmen kívül arra is alkalmas lehet, hogy tumor-kialakulás ellen védjen. Ha sikerül olyan peptideket találni, amelyeket csak a tumorsejtek fejeznek ki, akkor ezek segítségével, a fent említett logika szerint elérhető, hogy a rekombináns vakcinával kezelt állatokban ezek a tumorsejtek ne tudjanak szaporodni és egy idő után elpusztuljanak.
Szintén a bakteriális adenilát ciklázok tanulmányozása segítette hozzá Ullmannt és kollegáit, hogy egy szellemes rendszert fejlesszenek ki annak detektálására, hogy két tetszőleges fehérje a sejten belül összekapcsolódik-e.
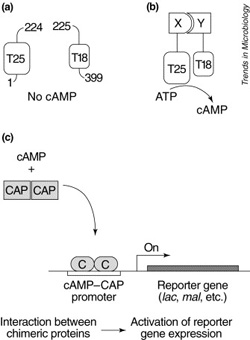 Ugyanis az alapból 45 kDa méretű adenilát-cikláz enyhe tripszines emésztés hatására egy 18 kDa (T18) és egy 25 kDa (T25) méretű fragmensre esik szét. Ezek önállóan nem mutatják az denilát cikláz aktivitást, de, meglepő módon, ha olyan körülmények adódnak, hogy egymáshoz közel kerüljenek a sejtben, akkor aktív adenilát-ciklázzá képesek összeállni. Ezt pedig, megfelelő genetikai háttérben, könnyen detektálni lehet.
Ugyanis az alapból 45 kDa méretű adenilát-cikláz enyhe tripszines emésztés hatására egy 18 kDa (T18) és egy 25 kDa (T25) méretű fragmensre esik szét. Ezek önállóan nem mutatják az denilát cikláz aktivitást, de, meglepő módon, ha olyan körülmények adódnak, hogy egymáshoz közel kerüljenek a sejtben, akkor aktív adenilát-ciklázzá képesek összeállni. Ezt pedig, megfelelő genetikai háttérben, könnyen detektálni lehet.
Ullmannék rendszerében a vizsgált fehérjéket (X és Y) a T25, illetve T18 fragmensekhez kötötték és a hibrid fehérjéket kódoló géneket egy adenilát-cikláz deficiens E. coli sejtben expresszálták. Ha az X és Y közt volt a sejtben interakció, a T25 és T18 képes lesz cAMP-t előállító enzimmé összeállni és cAMP jelenlétében a CAP által ativált katabolit operonok bekapcsolnak. Ez az ún. bakteriális “két-hibrid” rendszer (eukarióták esetében elsősorban élesztőben használnak nagyon hasonló logikával működő rendszert, hasonló célból).
Ez lenne tehát egy figyelemreméltó életpálya zanzásított összefoglalása. Ullmann Ágnes 1995 óta a Pasteur Intézet nyugalmazott professzora, 1998 óta az MTA külső tagja.
(A poszt megírásában elsősorban Ullmann Ágnes önéletrajzi esszéje segített, de ahol csak lehet, igyekeztem az eredeti cikkeket is ismertetni és linkelni a szövegben.)

Nagy orommel olvastam a cikket.
Szerencsesnek mondhatom magam, a nyolcvanas evekben egy kethetes tanfolyamon voltam tanitvanya Ullmann Ágnesnek, es kesobb egy konferencian ujbol talalkoztam es beszelgettem vele.
Megtiszteltetesnek tekintem.
Jo volt olvasni igy egyutt az egeszrol. Koszonom.
cink.hu/ne-mozdulj-es-ne-mondj-semmit-ullmann-agnes-tortenet-1632881541