Ha valaki szeret elgondolkozni a kutyavilág sokféleségén, akkor érdemes a fejébe vésnie Elaine Ostrander nevét, mivel a hölgy (és laboratóriuma) jelenleg igencsak bő forrása a legkülönbözőbb jellegek genetikai térképezésének. Az ő nevéhez fűződik, a kis eb-termet és az IGF1 gén adott allélja közti összefüggés megállapítása, a végtaghossz-különbözőségek fejlődési okának beazonosítása (jelen poszt témája), illetve a különböző szőrzettípusok genetikájának tisztázása (erről, remélem, hamarosan).
A rövid végtaggal rendelkező kutyák (pl. tacskók, bassett houndok) esetében, az már régóta világos volt, hogy egy örökletes fejlődési rendellenességről van szó: valamilyen oknál fogva azok a sejtek, amelyek a csont növekedését kellene szolgálják, idő előtt befejezik az osztódást és maguk is “elcsontosodnak”. (A deformált és rövid végtagok jelenlétének klinikai neve chondrodysplasia.) A miértre azonban eddig nem tudtuk a választ.
Ostranderék egy hatalmas adathalmazt gyűjtöttek össze, több száz kutya genomját (és a benne levő genetikai polimorfizmusokat) képesek megvizsgálni rövid idő alatt, aminek oroszlánrésze van abban, hogy viszonylag gyorsan tudnak érdekes tulajdonságoknak a genetikai okaira rákeresni.
Számos rövid ill. hosszú lábú eb fajta összehasonlításából aztán kitűnt, hogy a jelleg nagyon is kapcsolódik a 18. kromoszóma egy adott részén felfedezhető polimorfizmusokhoz, ami kevésbé szakzsargonban azt jelenti, hogy valahol ezek mellett van az a mutáció, amihez a jelleg köthető.
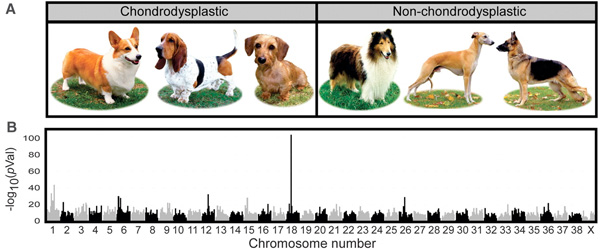
Érdekes módon, a standard kutyagenomban nem nagyon lehet fellelni egyetlen izgalmas gént sem a közelben, aminek egészen prózai oka van: nem egy “tradicionálisan” itt levő génben van a mutáció.
A chondrodypláziás kutyák esetében egy hívatlan vendég jelent itt meg: egy fgf4 retrogén. Mit is jelent ez: az fgf4 normál esetben egy négy exonból és három intronból álló gén (érdekes módon szintén a 18. kromoszómán van, de valahol nagyon máshol, mint a vizsgált régió). Az intronok aztán a transzkripció során/után kivágódnak, és így jön létre a bő 600 bázispár hosszúságú mRNS, ami aztán a fehérje szintézissorán lefordítódik. A vizsgált retrogén azonban egyáltalán nem rendelkezik intronokkal: szekvenciája szinte hajszálra megegyezik az érett mRNS-ével, aminek az a prózai oka van, hogy abból keletkezett. Egy véletlennek köszönhetően, egy ivarsejtben, feltehetően a retrotranszpozon aktivitásának köszönhetően jelenlevő reverz transzkriptáz a transzpozon saját genetikai állománya mellett egy fgf4 mRNS molekulát is “visszafordított” DNS-re, visszacsempészve a genomba. Az így keletkező új “retrogén” történetesen olyan szabályozó szekvenciák közelébe került, amelyek a fejlődés egy adott (csontfejlődés szempontjából kritikus) szakaszában aktiválják a gént a csontnövekedésért felelős sejtekben, amely nem kívánt aktivitásnak aztán egyenes következménye a chondrodyspláziás fenotípus.
A megfigyelés nem teljesen meglepő, mert egerekben és emberekben egyaránt az FGF jelátviteli úthoz lehet gyakran kötni a hasonló jellegű betegségeket. Ami azonban nem triviális, hogy a sok, egyébként igencsak különböző, rövid lábú fajtában ugyanaz a ritka mutáció felelős a jelleg megjelenéséért. Ez ugyanis azt jelenti, hogy még a kutyaszelídítés hajnalán jelent meg ez a mutáció a kutyaállományban és azóta is fennmaradt az emberi ízlésnek és gondoskodásnak köszönhetően.
(A borítókép a Wikimedia Commons oldaláról származik.)
Parker HG, VonHoldt BM, Quignon P, Margulies EH, Shao S, Mosher DS, et al. (2009) An expressed fgf4 retrogene is associated with breed-defining chondrodysplasia in domestic dogs. Science 325: 995-998.

Visszajelzés: Tömzsi lábakon – 2. - CriticalBiomass