 (Amikor közel három éve elindult a blog, létrejöttének egyik célja az volt, hogy magyarul tegyük elérhetővé és emészthetővé mindazt a tudományos irodalmat, amit a kreacionista körök (magyar színekben elsősorban az ÉRTEM) előszeretettel ignorálnak. S bár csak a posztok töredéke vette közvetlenül górcső alá a magyar “értelmes tervezés” hívek “érveit”, ez nem azt jelentette/jelenti, hogy ne lelhetnénk a honlapjukon tengernyi példáját a pszeudotudományos érveknek, a féligazságokból vagy teljes hamisságokból táplálkozó, nagyívű levezetéseknek. Most egyik olvasónk, SexComb vállalkozott rá, hogy kiveséz néhány ÉRTEM klasszikust, mi pedig természetesen örömmel biztosítjuk ehhez a platformot.)
(Amikor közel három éve elindult a blog, létrejöttének egyik célja az volt, hogy magyarul tegyük elérhetővé és emészthetővé mindazt a tudományos irodalmat, amit a kreacionista körök (magyar színekben elsősorban az ÉRTEM) előszeretettel ignorálnak. S bár csak a posztok töredéke vette közvetlenül górcső alá a magyar “értelmes tervezés” hívek “érveit”, ez nem azt jelentette/jelenti, hogy ne lelhetnénk a honlapjukon tengernyi példáját a pszeudotudományos érveknek, a féligazságokból vagy teljes hamisságokból táplálkozó, nagyívű levezetéseknek. Most egyik olvasónk, SexComb vállalkozott rá, hogy kiveséz néhány ÉRTEM klasszikust, mi pedig természetesen örömmel biztosítjuk ehhez a platformot.)
Mostanában egyre nagyobb népszerűségnek örvend egy nézet, amelyet hívei bizonyítékokkal alátámasztott, komoly tudományos elméletnek akarnak beállítani. Ez az elmélet az Értelmes Tervezés, avagy angol nevén az Intelligent Design, esetleg félig lefordítva intelligens tervezés . Ebben a cikkben szeretném megvizsgálni az elmélet egyik “bizonyítékát”, tárgyilagosan, a mai biológia szemszögéből, hogy az olvasó maga vonhassa le a megfelelő következtetéseket.
Maga az elmélet az ÉRTEM honlapján található, a jelöletlen idézetek ebből az írásból származnak.
Miről is van szó tulajdonképpen? A Nylon 6 az egyik első mesterséges polimer, 1935-ben állították elő. Nagy mennyiségben használja az ipar, így rengeteg kerül belőle a szemétbe is. Magyar neve nejlon, bár az általános iskolai olvasókönyvemben még “nylon” –nak írták. Azért nevezzük polimernek, mert azonos alapszerkezetű, rövidebb molekulákból áll, amelyekből sokat – legalább százat – kovalens kémiai kötésekkel kapcsolnak egymáshoz, így fonálszerű, szálas szerkezetű anyagot nyernek. A nejlont e-kaprolaktámból állítják elő, készítésekor a hexametilén diamin és adipinsav monomerek, dimerek (kovalens kémiai kötéssel összekapcsolódó két hexametilén diamin molekula) és körkörössé záródott, fonálszerű szerkezetet fel nem vevő oligomerek is képződnek. Ezek a gyártás melléktermékei, amelyekről sokáig azt gondolták, hogy egyetlen élőlény sem képes lebontani őket, így ezen szennyező anyagok eltakarítása komoly környezetvédelmi kérdéssé vált.
 Japán kutatók meglepő felfedezést tettek a hetvenes években, vegyi üzemek hulladékában olyan baktériumokat találtak, amelyek képesek voltak egyedül ezen a nejlonhulladékon élni, nem igényeltek más szén vagy nitrogénforrást. Ennek a jelentősége nyilvánvaló, a nejlonhulladék nehézkes vegyi lebontása helyett sokkal egyszerűbb lenne vízbe áztatni, hozzáadni a baktériumokat és egyszerűen megvárni, amíg azok megeszik a szemetet. Nyilván elegáns, környezetkímélő megoldás, így azonnal kutatni is kezdték a nejlonevő baktériumokat. A két csodabaci a Flavobacterium sp. K172 (IFO14590) és a Pseudomonas sp. NK87. (Ez az elnevezés annyit jelent, hogy egyik baktériumot sem sikerült fajba sorolni, egyszerűen megállapították a nemzetségüket és kaptak egy-egy törzsszámot, ezért áll a fajnév helyett “sp.”.) Ezek a baktériumok nem állnak egyedül ezzel a különleges képességükkel, találtak azóta egy Pseudomonas aeruginosa törzset, amely képes az e-kaprolaktámot emészteni és egy korhasztó gombát is, amely képes megemészteni a nejlonhulladékot.
Japán kutatók meglepő felfedezést tettek a hetvenes években, vegyi üzemek hulladékában olyan baktériumokat találtak, amelyek képesek voltak egyedül ezen a nejlonhulladékon élni, nem igényeltek más szén vagy nitrogénforrást. Ennek a jelentősége nyilvánvaló, a nejlonhulladék nehézkes vegyi lebontása helyett sokkal egyszerűbb lenne vízbe áztatni, hozzáadni a baktériumokat és egyszerűen megvárni, amíg azok megeszik a szemetet. Nyilván elegáns, környezetkímélő megoldás, így azonnal kutatni is kezdték a nejlonevő baktériumokat. A két csodabaci a Flavobacterium sp. K172 (IFO14590) és a Pseudomonas sp. NK87. (Ez az elnevezés annyit jelent, hogy egyik baktériumot sem sikerült fajba sorolni, egyszerűen megállapították a nemzetségüket és kaptak egy-egy törzsszámot, ezért áll a fajnév helyett “sp.”.) Ezek a baktériumok nem állnak egyedül ezzel a különleges képességükkel, találtak azóta egy Pseudomonas aeruginosa törzset, amely képes az e-kaprolaktámot emészteni és egy korhasztó gombát is, amely képes megemészteni a nejlonhulladékot.
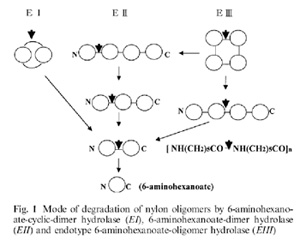
Három különböző fehérjét azonosítottak, egy EI nevűt, (ünneplős nevén: 6-aminohexanoate cyclic dimer hidrolase), amely a gyűrűvé záródott dimereket emészti, egy EII nevűt, (ünneplős nevén 6-aminohexanoate dimer hidrolase) amely a hosszabb polimer láncok végéről hasít le egy-egy egységet és az EIII jelűt (ünneplős nevén 6-aminohexanoate oligomer hyrolase), amely a gyűrűvé záródó mellékterméket képes emészteni. A jobboldali ábrán van egy összefoglaló ábra a vázlatos működésükről (Negoro S. 2000):
Ezek közül az enzimek közül az Acromobacter guttatus-ból származó EI típusú fehérjét és a Flavobacterium sp. K172 EII típusú fehérjéjét vizsgálták részletesen, kipróbálták, hogyan emészt különböző nejlonszármazékokat, antibiotikumokat, néhány mesterségesen előállított amidot, tejfehérjét, különböző peptideket (A peptidek tulajdonképpen rövid fehérjék, néhány tucatnál kevesebb aminosavból állnak.), amelyekről valóban meg kellett, hogy állapítsák, hogy ezeket nem emészti. Ebből azonban nem lehet levonni a következtetést:
” Ezek egyike sem rendelkezett katalitikus aktivitással a természetben előforduló amid-vegyületek kapcsán, ami azt sugallta, hogy ezek az enzimek teljesen újak, és nem csupán a már meglévő enzimek módosult formái.”
Ugyan valóban több mint száz vegyületet megvizsgáltak, azonban ezek nagy része vegyipari származék, műanyaggyártás során keletkező termék, amelyeket vagy vegyipari cégektől, gyógyszergyáraktól vásároltak vagy maguk állítottak elő, így ebben a kísérletben az egyetlen természetes anyag a tejfehérje volt, illetve a néhány különböző peptid, amelyeket ez az enzim nem bont le. És? A természetben e mellett nyilván mérhetetlenül sok amidvegyület létezik, amelyeket egyáltalán nem vizsgáltak. A félreértés oka valószínűleg Kakudo S. és munkatársai 1993 –as cikke, amelyben az EIII enzimet vizsgálták és szerepel benne egy elég homályos kitétel:
“However the EIII enzyme, at a concentration of 0,9 mg/ml showed no activity towards any of the naturally occouring peptides tested to date…”
Azaz az EIII enzim egyik eddig vizsgált természetes peptidet sem emésztette. No most ebben cikkben nem részletezik, mik voltak ezek a vizsgált peptidek, viszont a cikk szerzői között ott van egy bizonyos Seiji Negoro és Hirosuke Okada, akik a témában említett összes cikk társszerzői, így valószínűsíthetően az első két alkalommal kipróbált peptidekről, azaz rövidke fehérjékről van itt szó, mivel ugyanabban a laborban végezték a kísérleteket. Amennyiben eltértek volna a szokásos eljárástól, azt leírták volna, azonkívül teljesen valószínűtlen, hogy valaki a természetben megtalálható összes peptidet vizsgálná, nyilván pénze, ideje sem lenne rá, hiszen itt több millió különböző vegyületről beszélünk, amelyek nagy része kereskedelmi forgalomban nem kapható, így a reménybeli kutatónak magának kellene őket tisztítania. Azonkívül feltételezhetően nem ismerjük a természetben előforduló összes peptidet. Ami kijelenthető: ennek az enzimnek nem találták meg a természetes szubsztrátját, de ettől még nyugodtan lehet ilyen, hiszen alig néhány vegyületet vizsgáltak meg, a természetben létező szédítően sokból.
Megvizsgálták, azt is, hogy egyes baktériumok mely génjei kódolják ezt a három fehérjét. A Flavobacterium sp. K172 törzsének vizsgálata során kiderült, hogy ezek a gének (EI-nylA, EII-nylB, EIII-nylC) egy plazmidon találhatóak, ez a pOAD2. A plazmidok olyan körkörös DNS molekulák, amelyek bár fehérjéket kódoló géneket tartalmazhatnak, mégis a baktériumsejtekben a kromoszómától függetlenül léteznek és szaporodnak. A baktériumok nagy gyakorisággal képesek kicserélni plazmidjaikat, ráadásul az egyes fajok között is képesek átjárni, így egy-egy plazmidon hordozott, előnyös gén gyorsan elterjedhet a mikróbák körében.
A pOAD2 plazmid a már említett három gén mellett még egy, a mi szempontunkból érdekes gént, a nylB’ –t, amely egy EII’ nevű, az EII -höz nagyon hasonló fehérjét kódolt. (392 aminosavból csak 46 különbözött az EII –hez viszonyítva.) Az értelmes tervezés hívei sajnálatos módon ki szokták felejteni ezt a fehérjét, ám szerény véleményem szerint mégiscsak fontos. Megvizsgálták ugyanis, és kiderült, hogy ez az EII’ enzim is képes a nejlonszemetet emészteni, hasonló mechanizmussal, mint az EII, viszont kétszázszor kisebb aktivitással. Itt ugye fölmerül a kérdés, hogy miért tesz a feltételezett értelmes tervező egy teljesen újonnan tervezett, nyilván rokon nélküli fehérje mellé egy másikat, amely nagy mértékben hasonlít rá, ugyanazt a nejlont bontja, ám kétszázszor rosszabbul működik? Ennek fényében érdekes Don Batten kijelentése:
“A kutatóknak nem sikerült kimutatniuk semmilyen feltételezett, ősi nylon-lebontó gént”.
Nem lehet, hogy éppen azt látjuk a szemünk előtt? Részletesen megvizsgálták ezt az EII’ fehérjét és arra jutottak, hogy ha mindössze két aminosavat megváltoztatnak rajta, az aktivitása eléri az EII enzimét. (Ez később még fontos lesz!) Az én magyarázatom sokkal egyszerűbb, létezett egy EII’ fehérje ebben a jószágban, amely valamilyen, a baktérium élőhelyén található vegyületet bontott. A fehérjét kódoló gén duplikálódott (megkettőződött), majd az egyik változatban mutációk szaporodtak fel, amivel kialakult egy enzim, amely az eredeti szubsztrátot már nem emésztette, ám elbontotta a nejlonhulladékot.
“Ezek egyike sem rendelkezett katalitikus aktivitással a természetben előforduló amid-vegyületek kapcsán, ami azt sugallta, hogy ezek az enzimek teljesen újak, és nem csupán a már meglévő enzimek módosult formái.”
Viszont találtak egy enzimet, amely meglehetősen rosszul, de emésztette a nejlonhulladékot. Nem azt sugallja éppen ez, hogy ez az enzim, amely eredetileg valamilyen teljesen más vegyületet bontott le, kis változások után (két aminosav cseréje) képessé vált egy új anyag hatékony emésztésére? A nejlon a természetben ezertonnaszám hever szabadon, áldásos tevékenységünk nyomán, így akárhogyan is de jelentős kihasználatlan táplálékforrást jelent.
Ebben a magyarázatban kívülállók számára fura lehet “az egyik változatban mutációk szaporodtak fel” kitétel, de hadd magyarázzam meg: Miért csak az egyik változat “gyűjtött” mutációkat, a másik miért nem? Tegyük fel, hogy az EII’ enzim ebben az esetben az ősibb alak, amely valami olyasmit bont, ami a baktérium fontos tápláléka a természetben. A fehérjét kódoló gén megkettőződik valamilyen mutációs esemény során. (Az ilyen duplikációk jól ismertek szinte minden vizsgált fajban.) Ezek után a baktériumnak két génje kódol két egyforma fehérjét, mindkét gén átíródik, mindkettő fehérje működik. Ha az egyik egy mutációt szenved el, amelyik elrontja, vagy csak lecsökkenti az aktivitását, a sejt azonnal a másik példányra szorul, ha nem akar éhenhalni, így ekkor csak az egyik fehérje működőképes, de ez is el tudja látni a feladatát. Az a sejt, amelyikben mutáció történik a működő EII’ változatban is, megdöglik, mert hiányozni fog egy fontos enzimje, így ezt a változatot nem örökíti át utódaira, míg ha a már egyszer elromlott példányban szenved mutációs eseményeket, semmi sem történik, az a fehérje már úgysem működött rendesen. Így lehet, hogy az egyik gén viszonylag gyorsan változik, mondhatni felszabadul a szelekciós nyomás alól, míg a másik megőrzi a működőképességét.
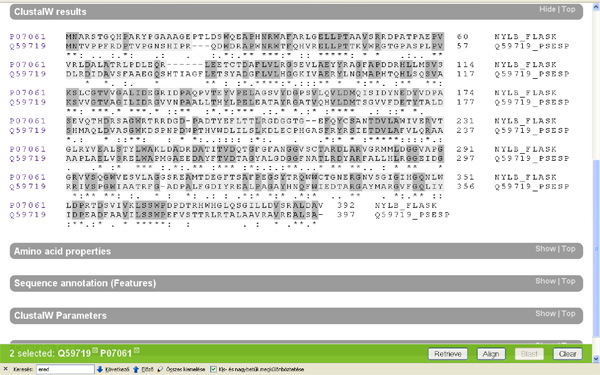
No most, hogy ne csak a levegőbe beszéljek, felkérlek, kedves olvasó, hogy te is nézz utána az állításaimnak! A www.uniprot.org címen található a legnagyobb egységes fehérje-adatbázis, amely elméletileg minden azonosított fehérjekódoló gén termékét tartalmazza, aminek az aminosavszekvenciáját valaha is közreadták. Először is írjuk be a keresőablakba, hogy “6-aminohexanoate”! Az adatbázisban több mint száznyolcvan fehérje található, amelyek a legkülönbözőbb baktériumokból származnak, és amelyek mind a fentebb tárgyalt nejlonemésztő enzimekhez hasonlóak. (“A kutatóknak nem sikerült kimutatniuk semmilyen feltételezett, ősi nylon-lebontó gént.” – Azért ez mégiscsak jó pár hasonló fehérje, rengeteg különböző mikróbából.) Ha kijelöljük a keresett öt fehérjét, amelyek a Flavobacterium sp. K172 törzséből származó három fehérjét, (EI, EII, EII’ – Ezeket a nylA, nylB és nylB‘ gének kódolják) és a Pseudomonas sp. NK87 törzséből származó két fehérjét (EI és EII – nylA, nylB), akkor megvizsgálhatjuk magukat a fehérjéket is. (Lásd a képet!)
(Klikk a képere a nagyításhoz.)
Ha oldalt a kis dobozba egy pipát teszünk a minket érdeklő fehérjék mellé és megnyomjuk a jobb alsó sarokban található “Align” feliratú gombot, akkor a számítógép összehasonlítja nekünk a kiválasztott fehérjéket. Nézzük meg először a két faj EI enzimjét! (nylA) A gép a tömörség kedvéért egy aminosavat egy betűvel jelöl (ennek a rövidítési módnak a megfejtését lásd itt) és sötétszürkére színezi a két fehérjében azonos aminosavakat.
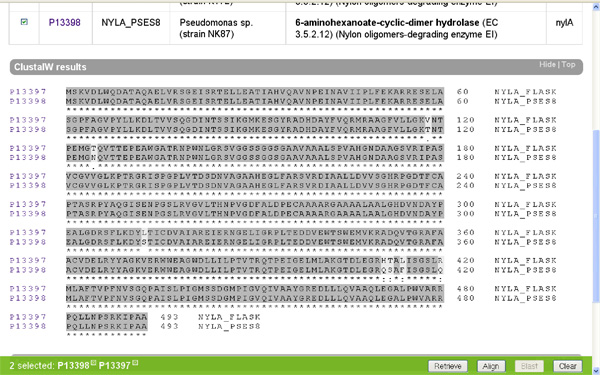
Azt hiszem meglepő az eredmény, a két jószág EI fehérjéje alig különbözik egymástól. Mielőtt az értelmes tervező munkájára kezdenénk gyanakodni, azért hasonlítsuk össze más fajok EI enzimjeit is (nylA)! (Én éppen a Myxococcus xanthus; Burkholderia mallei; Silicibacter pomeroyi társaságot választottam, hasraütéses alapon.) Ami látszik, az az, hogy az elsőként vizsgált két fajnak az EI enzimje valamiért nagyon hasonlít egymásra, ám a többi vizsgált fajban található hasonló fehérjékre nem. Felmerül a kérdés, hogy ha létezik értelmes tervező, miért készít ennyi változatot a nem is olyan régen értelmesen tervezett fehérjéből? Főleg annak fényében, hogy maga a nejlon nem változott, a feltalálása óta ugyanaz a szerkezete. Ezt biztosan tudjuk, mert mi emberek gyártjuk.
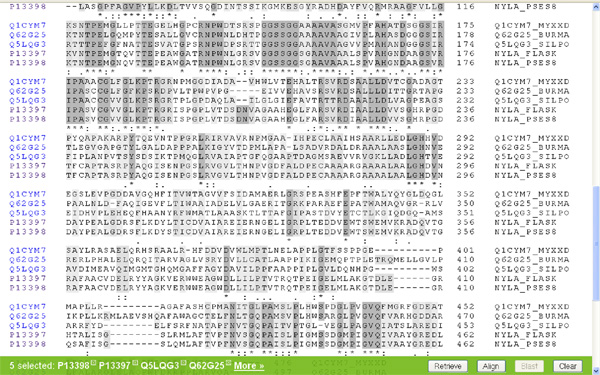
Hasonlítsuk össze az eredeti két faj (Flavobacterium sp. K172; Pseudomonas sp. NK87) EII fehérjéit is (nylB)! Itt már egészen más a helyzet, ez a két fehérje eléggé különbözik egymástól. Nyilván felmerül a kérdés, hogy miért tervez az értelmes tervező ennyire különböző enzimeket ugyanarra a feladatra? Ráadásul felmerül a kérdés, hogy miért van az, hogy a két, elsőként felfedezett nejlonszemetet bontani képes baktériumnak miért azonos szinte az EI enzimje, de miért különbözik ennyire az EII enzimje? A feltételezett értelmes tervező miért viselkedett ennyire különbözőképpen a két szervezet esetében?
Ezen kívül találtam még egy cikket (Deguchi T. és munkatársai 1998.), ahol egy IZU-154 nevű korhasztó gombát vizsgáltak, amely szintén képes nejlont bontani. E gomba azonban egy mangán peroxidáz nevű enzimet használ erre a feladatra, amely minden mérhető és nem mérhető tulajdonságában különbözik az eddig megismert enzimektől, ráadásul a fehérje aminosavszekvenciája sem emlékeztet az eddig tárgyalt Flavobacterium és a Pseudomonas fehérjék egyikére sem. Felmerül a kérdés, hogy a feltételezett értelmes tervező miért tervezett ugyanarra a feladatra még egy, az előzőtől teljesen különböző rendszert?  Ráadásul miért éppen egy olyan fehérjét, amelyik egyértelműen egy mangán peroxidáz enzim, amelynek ismert a természetes szubsztrátja is: a faanyagban található lignin, ami egy természetes polimer, szinte minden fás növény nagy mennyiségben termeli. Valószínűsíti ez a mangán peroxidáz enzim értelmes tervezettségét? Ha pedig azt is hozzáteszem, hogy ennek az egy gombának legalább négy mangán peroxidáz enzimet kódol a genomja, ez a tény még nagyobb teret hagy az evolúciónak, mert az egyik kiesése, mutációja nem okoz túl nagy hátrányt a gazdaszervezetnek. Nyilván ez még kevéssé teszi valószínűvé ezen enzimek értelmesen tervezett voltát. Ha ez az enzim, amelynek a természetben megtalálható szubsztrátja ismert, bizonyos mutációs események nyomán alkalmassá válhat az új táplálékforrásként megjelenő nejlon emésztésére, nem valószínűbb inkább, hogy a Flavobacterium-ok és a Pseudomonas-ok esetében is ez történt? Ugyanennek a folyamatnak a leírásához az ő esetükben egyedül annyi hiányzik, hogy nem ismerjük ezen enzimek eredeti szubsztrátját, ami nyilván nem jelenti azt, hogy ilyen nincs, csak annyit, hogy senki sem vizsgálta. Ennek fényében mennyire hihető a nejlonemésztő enzimek értelmes tervezettsége? (Az ábra a gomba nejlonbontó enzimje által megmart nejlonszálakat mutat, ugyanebből a cikkből származik.)
Ráadásul miért éppen egy olyan fehérjét, amelyik egyértelműen egy mangán peroxidáz enzim, amelynek ismert a természetes szubsztrátja is: a faanyagban található lignin, ami egy természetes polimer, szinte minden fás növény nagy mennyiségben termeli. Valószínűsíti ez a mangán peroxidáz enzim értelmes tervezettségét? Ha pedig azt is hozzáteszem, hogy ennek az egy gombának legalább négy mangán peroxidáz enzimet kódol a genomja, ez a tény még nagyobb teret hagy az evolúciónak, mert az egyik kiesése, mutációja nem okoz túl nagy hátrányt a gazdaszervezetnek. Nyilván ez még kevéssé teszi valószínűvé ezen enzimek értelmesen tervezett voltát. Ha ez az enzim, amelynek a természetben megtalálható szubsztrátja ismert, bizonyos mutációs események nyomán alkalmassá válhat az új táplálékforrásként megjelenő nejlon emésztésére, nem valószínűbb inkább, hogy a Flavobacterium-ok és a Pseudomonas-ok esetében is ez történt? Ugyanennek a folyamatnak a leírásához az ő esetükben egyedül annyi hiányzik, hogy nem ismerjük ezen enzimek eredeti szubsztrátját, ami nyilván nem jelenti azt, hogy ilyen nincs, csak annyit, hogy senki sem vizsgálta. Ennek fényében mennyire hihető a nejlonemésztő enzimek értelmes tervezettsége? (Az ábra a gomba nejlonbontó enzimje által megmart nejlonszálakat mutat, ugyanebből a cikkből származik.)
Az ugráló genetikai elemekről
A Flavobacterium pOAD2 plazmidja ezen kívül tartalmaz még ugráló genetikai elemeket, ünneplős nevükön transzpozonokat, amelyek valamiért központi helyre kerültek az értelmes tervezők érvelésében. Őszintén szólva nem tudom, mennyire ismertek ezek az elemek az átlagembernek, így mindenképpen szeretném megvilágítani, hogy ezek nem valamilyen sosemlátott, teljesen egyedi jellegzetességei ennek a rendszernek, hanem szokásos, minden élőlényben jelen lévő alkotóelemek. Különböző ugráló genetikai elemeket eddig minden fajban találtak, ahol csak kerestek, ezek olyan DNS szekvenciák, amelyek képesek változtatni a helyüket a genomon belül. A lényegük elég nehezen megragadható, talán legjobban egy vírushoz hasonlíthatóak, viszont nincs semmilyen fertőző, vagy külső alakjuk, a sejten belül egyik DNS szakaszból a másikba kerülnek át. Igazából nem világos, hogy ezek léte vagy nem léte miért ennyire fontos ebben az esetben, valamiért az értelmes tervezés szempontjából különösen fontosak, de igazság szerint nem értem miért. Egy plazmid DNS szekvenciájának meghatározása tulajdonképpen egy pillanatfelvétel arról az egy plazmidról abból az egyidőpontból. Mivel az ugráló genetikai elemek nemzedékek alatt képesek megváltoztatni a helyüket (egy nemzedék egy kólibaktériumnál például fél óra.), így egyáltalán nem biztos, hogy ha egy másik időpillanatban is megszekvenálták volna, akkor is ugyanitt lettek volna, így sajnos ebben az esetben az ugráló genetikai elemek elhelyezkedését nagyon óvatosan kell, hogy kezeljük és különösen vigyáznunk kell az ezekből levont következtetésekkel.
“Negoro szerint a transzpozonok csak „kései toldalékok”. Erre vonatkozólag azonban nincs valódi bizonyíték.”
“A pOAD2 plazmidon öt transzpozon található. Amikor ezek aktiválódnak, akkor a rajtuk kódolodott transzpozáz enzim genetikai rekombinációt okoz. Külső stressz, mint például a magas hőmérséklet, a mérgező anyagok, vagy a tápanyaghiány aktiválhatja a transzpozázokat. A plazmidon ilyen számban jelenlevő transzpozázok arra utalnak, hogy a plazmid arra lett tervezve, hogy adaptálódjon, amikor a baktériumot stresszhatás éri.”
“S ezt az eredményt mindössze 9 nap alatt érték el!”
“Ilyen rekombinációs mechanizmus azonban ismeretlen, de nagyon valószínű, hogy a transzpozáz gének szerepet játszanak ebben.”
Ha Don Batten nem hiszi el, hogy ezek a transzpozonok “kései toldalékok”, akkor miért számol komolyan azzal a lehetőséggel, hogy ugranak? Amennyiben nem változtatták meg a helyüket az általa feltételezett értelmes tervezés óta (legalább tízezer éve) miért éppen most tennék? Először állítja, hogy nincs bizonyíték arra, hogy ezek az ugráló genetikai elemek valaha is máshogyan helyezkedtek volna el a plazmidon, majd megállapítja, hogy stresszhatásra gyakran helyet változtatnak, sőt, mindez kilenc nap alatt lejátszódik, sőt egy rekombinációs rendszer részei. Ez a két állítás erősen ellentmond egymásnak. Nem mellesleg ebben a szervezetben ennek a transzpozonnak az ugrását senki sem vizsgálta, tehát arra sincs éppen semmilyen bizonyíték sem, hogy egyáltalán képes megváltoztatni a helyét. Akkor a két-három egymást kizáró állítás melyike sugallja ennek a plazmidnak az értelmesen tervezett eredetét?
A helyzet az, hogy ezen ugráló genetikai elemeket részletesen megvizsgálták. A Flavobacterium sp. K172 törzsében ilyen ugráló genetikei elemek egyedül a pOAD2 plazmidon találhatóak, a másik két plazmidon és a kromoszómán nem. Ebben a jószágban ez a plazmid hordozza az EI, EII EIII és az EII’ enzimeket kódoló géneket is. Ráadásul az EII enzimet kódoló nylB és az EII’ enzimet kódoló nylB’ gének is egy-egy ugráló genetikai elem belsejében foglalnak helyet, így ezek a gének elméletileg szabadon változtathatják a helyüket a genomban, ugyanis az ugráló genetikai elem helyváltoztatásakor ezen géneket is magával viszi (Kato és munkatársai 1994.). Ez a jól ismert, számtalan esetben megfigyelt folyamat, azaz egy ugráló genetikai elem helyváltoztatása éppen felelős lehet a nylB’ gén megkettőződéséért de a gén szekvenciáját, azaz információtartalmát, így az általa kódolt enzimet semmiképpen sem változtatja meg.
A Pseudomonas sp. NK87 törzsnek egyedül a pNAD2 plazmidja tartalmaz IS6100 típusú ugráló genetikai elemeket, amelyik az EI enzimet is kódolja, míg a többi öt plazmidja és a kromoszómája mentes ezektől. A pNAD2 plazmid szekvenciája ismeretlen, mivel soha senki sem szekvenáltatta meg, így mindössze annyit tudunk róla, hogy ezen van a Flavobacterium-éhoz rendkívül hasonló nylA gén és hogy van rajta valahol IS6100 ugráló genetikai elem. Sajnos ezen információk alapján elég kevés megalapozott következtetés vonható le erről a plazmidról, így nem is nagyon bocsájtkoznék találgatásokba az eredetéről, illetve a Flavobacterium pOAD2 plazmidjához való hasonlóságáról. Található rajta egy nylA gén és IS6100 ugráló genetikai elem, ennyiben hasonlít a pOAD2 –höz, viszont nem található rajta működőképes fehérjét kódoló nylB, nylB’, nylC gén, ennyiben különbözik tőle. Ami érdekes, hogy ez a jószág az EII enzimjét kódoló nylB gént egy másik plazmidon, a pNAD6 –jelűn tartalmazza, amely viszont mentes az IS6100 típusú ugráló genetikai elemektől (Kato K. és munkatársai 1994.), tehát ennek a jószágnak a nylB génje nem ugráló genetikai elemben ül, azaz jelentősen különbözik a Flavobacterium-étól , ráadásul a Don Batten által feltételezett rekombinációs rendszer elemei nem is találhatóak meg a közelében. Újra felmerül a kérdés, hogy ugyanannak a feladatnak a megoldására miért készít a feltételezett értelmes tervező két külön rendszert?
Az egyik szervezetben egy pOAD2 típusú plazmidra tesz három nejlonbontó enzimet, meg egy olyat, ami a nejlonszemetet rosszul bontja, de hasonlít az egyik nejlonbontó enzimre. A másik fajban egy, a pOAD2 –re hasonlító plazmidra tesz egy nejlonbontó enzimet, amely 99% -ban hasonlít a másik szervezet egyik nejlonbontó enzimére, és egy másik, az elsőre nem igazán hasonlító plazmidra tesz egy másik nejlonbontó enzimet, amely csak 35% -ban hasonlít az első szervezetben ugyanezt a feladatot ellátó enzimre, a harmadik enzimet pedig lefelejti. Miért van az, hogy az egymásra inkább hasonlító plazmidok mindkét esetben meglepően hasonló enzimet kódoló gént tartalmaznak, míg az erre nem hasonlító (IS6100 elemeket nem tartalmazó) plazmidon a Flavobacterium-étól eltérő enzimet kódoló gén található? Azért akárhogyan is nézzük, ezek a tények nem támasztják alá ezen fehérjék értelmes tervezettségét, hanem inkább véletlenszerű folyamatokra utalnak.
“Úgy tűnik, hogy minden egyes szekvenciában a kodonok (bázispár tripletek) rekombinációja – nem pedig egyedi bázisoké – történt meg a „start” és a „stop” kodonok között. Ez lenne a legegyszerűbb módja annak, hogy az antiszenz-szálon ne jöjjön létre „stop” kodon.”
“Ilyen rekombinációs mechanizmus azonban ismeretlen, de nagyon valószínű, hogy a transzpozáz gének szerepet játszanak ebben.”
Azt szeretném megkérdezni, hogy ez a módszer miért ne eredményezne STOP kodont? Az Aszparagint jelentő AAT kodon visszafelé olvasva TAA, azaz STOP, az Aszparaginsavat jelentő GAT visszafelé olvasva TAG, azaz STOP, a Szerint jelentő AGT visszafelé olvasva TGA, azaz STOP. Amennyiben Don Batten a másik szálra gondolt, azaz ezen szekvenciák reverz komplementerére, akkor sem változik a kép, a Leucint jelentő TTA kodon reverz komplementje TAA, azaz STOP, a Leucint jelentő CTA reverz komplementje TAG, azaz STOP, míg a Szerint jelentő TCA reverz komplementje TGA, azaz STOP. Hiába történik a mutáció nem bázisok, hanem tripletek szintjén, az eredmény ugyanaz, így is lehetnek benne STOP kodonok, azaz Don Batten feltételezte ismeretlen rekombinációs rendszer egyszerűen nem működne, mert ugyanúgy eredményezne STOP kodonokat is. Így azért nem csoda, hogy soha nem találták nyomát még hasonlónak sem.
A Baktériumok változékonyságáról
“A japán kutatók kimutatták, hogy a nylon-lebontó képességet de novo is ki lehet mutatni. Olyan Pseudomonas aeruginosa POA törzs laboratóriumi tenyészetében tapasztalták ezt, amely eredetileg nem tartalmazott nylon oligomerek lebontásához szükséges enzimeket.”
Itt Prijambada I. D. és munkatársai 1994 –es cikkére hivatkozik Don Batten. De miről is szól ez a cikk? Azt vizsgálták, hogy egy Pseudomonas aeruginosa törzs képes –e átszokni a nejlonszemétre. Ez a vad típusú Pseudomonas aeruginosa képtelen volt nejlonszeméten élni, ám hogyha megfelelően sok sejtet szélesztettek szénforrásként kizárólag nejlonszemetet tartalmazó táptalajra, kilenc nap alatt ezen a táptalajon is baktériumtelepek jelentek meg. 10-3 eséllyel kaptak nejlont is emészteni képes sejteket, ami annyit jelent, hogy csak minden ezredik sejt tudta megemészti a nejlont, kilenc napnyi szenvedés árán, a többi kilencszázkilencvenkilenc egyszerűen éhen halt. Ezeket a nejlonon is élni képes baktériumokat felszaporították, majd fagyasztással összetörték a sejtfalukat, a sejtplazmájukat kicsorgatták és mérték, emészti –e a nejlonszemetet? Csodák csodája, a jószágok az átszoktatás előtt nem emésztették a nejlont, utána pedig igen. Azonban ha a kiindulási törzsből eredetileg is csak minden ezredik volt képes nejlonbontó enzimet termelni (tekintsünk el attól, hogy kilenc nap alatt is történhettek mutációk, márpedig minden bizonnyal történtek), ez valószínűleg egyszerűen túl kevés ahhoz, hogy ki lehessen mutatni, így nem csoda, ha nem látták, hogy emésztené a nejlont, mivel itt néhány millió darált sejtet használtak fel a méréshez mindkét esetben.
A kiindulási Pseudomonas törzs genomjáról, plazmidjairól igazából semmit sem tudunk, mivel ezt nem vizsgálták. Ha megnézzük a Uniprot adatbázisában (“pseudomonas aminohexanoate”), akkor hét hasonló enzimet találunk, amelyeket különböző Pseudomonas fajokból írtak le:
EI: P. sp. NK87; P. mallei; P. syringae pv. tomato;
E II: P. solanaceum; P. putida (strain W619); Pseudomonas aeruginosa (strain PA7); P. sp. NK87
A Pseudomonas fajokból kimutatott hasonló fehérjék jelzik, hogy ezek a baktériumok igenis tartalmaznak a nejlonlebontáshoz szükséges enzimekhez hasonló fehérjéket, így ez a fajta alkalmazkodás igenis lehet egyszerű szelekciós nyomás következménye, mivel a sejteknek csak nagyon kis része képes rá egyáltalán, ráadásul van “alapanyag” is a mutációs változásokhoz.
“Az adaptáció (alkalmazkodás) ilyen gyorsasága egy speciális mechanizmus létére utal, nem pedig olyan véletlenszerű folyamatokra, mint a random mutáció és szelekció.”
No most, ha ennek a jószágnak egy éppen erre készült rendszere lenne, akkor miért csak minden ezredik volt képes alkalmazkodni az új táplálékhoz? A többi kilencszázkilencvenkilenc miért nem? Azokban miért nem működött ez a rendszer? Nem túl költséges fenntartani egy külön rekombinációs rendszert csak azért, hogy minden ezredik sejtben működjön? Amúgy egy véletlenszerű rekombinációs rendszer jelenléte nem éppen az értelmes tervező léte elleni bizonyíték lenne? Ezekre a kérdésekre semmilyen választ sem ad az értelmes tervezés elmélete.
” A Pseudomonas aeruginosa-t Schroeter fedezte fel és nevezte el 1872-ben. Ma is ugyanazok a tulajdonságok jellemzik ezt a baktériumot, mint akkoriban. Annak ellenére tehát, hogy rendkívül gyakori, igen életképes és nagyon gyorsan adaptálódó faj, ez a faj nem „fejlődött” másmilyen típusú baktériummá.”
Nyilván a baktériumokban maguktól is történnek mutációs események. Ezek nem sokat jelentenek laborkörülmények között, mivel cukrot, tejfehérjét, élesztőkivonatot, sókat, egyéb földi jókat kapnak készen a sejtek, amelyet éppen arra találtak ki, hogy minél gyorsabban szaporodjanak. Ilyen körülmények között rengeteg olyan mutáns is életben marad, amely a természetben elpusztulna, mivel nagy mennyiségű táplálékot kapnak a sejtek, nem vadásznak rájuk ragadozók, ráadásul más baktériumok sem szorítják ki őket erről a jó kis helyről. Ilyen körülmények között nyilván minden egyes egyed életképes, amely cukrot, fehérjét képes emészteni, és osztódni is tud. Minden más tulajdonságuk másodlagos, így ezekre szelekciós nyomás sem hat. Hova kellene fejlődniük? A környezetüket úgy alakították ki, hogy éppen tökéletes legyen nekik. Milyen szelekciós nyomás nehezedik rájuk? Nem sok. Minden táplálékot készen kapnak, semmi más dolguk sincs, csak osztódni. Nem kell versengeniük, nem támadják meg őket vírusok, vagy más baktériumok, esetleg egysejtű ragadozók, nem bombázzák őket antibiotikumokkal. Ugyanazt a táplálékot kapják, amit száz éve is. Ráadásul a Pseudomonas aeruginosa jellemzői nem túl szorosak: Gram-negatív, aerob, azaz oxigén jelenlétében is életképes, tömzsi pálca alakú. A legtöbb törzse egy ostort visel a sejt egyik pólusán. A leggyorsabban 37 C fokon osztódik. Egy kék színű és egy ibolyántúli fényben világító festéket termel és ellenálló számos antibiotikumra. Azért lássuk be, ezek elég tág fogalmak! Egyrészt a baktériumok körében a “faj” rengeteg változékonyságot enged meg. Azon kívül, mint a fenti kísérletek is mutatják, elég nagy változékonyságúak ezek a szervezetek, ráadásul viszonylag gyorsan alkalmazkodnak új körülményekhez.
Ezen kívül az ilyen szervezetek laborkörülmények között tartása egyszerűen meggátolja a változásukat. Ezeket a törzseket legtöbbször fagyasztva tárolják, mert sokkal olcsóbb, mint folyamatosan fenntartani őket. Így egy-egy labortörzs éveken át egyet sem osztódik, amikor mégis előveszik őket, akkor is csak ellenőrzik, hogy még ugyanaz a szervezet –e, ami a csőre van írva (Nyilván a feliratozási hibák elkerülése végett.), majd egy új adagot fagyasztanak le belőlük. Lássuk be, ez nem kedvez a gyors változásoknak! Ráadásul tegyük fel, hogy történik egy mutáció, mondjuk az egyik sejt elkezd egy zöld színanyagot termelni, a kék helyett. Ezt az első lemezre kenés alkalmával észlelik a vele foglalkozó kutatók, laboránsok és úgy ahogy van kidobják a francba. Esetleg ilyenkor újra ellenőrzik a törzsüket, amennyiben abban is ilyen sejtek találhatóak, az egészet kidobják és a törzsközpontból újat rendelnek. Ha egy Pseudomonas aeruginosa bármilyen érzékelhető tulajdonsága megváltozik, azonnal kidobják a törzset és újat indítanak azokból, amelyek az eredetileg leírt jellegzetességeket mutatják. Ilyen körülmények között nem hiszem, hogy csoda, ha száz év alatt sem történt semmilyen látható változás ebben a jószágban. A nem látható tulajdonságokban bekövetkezett változásokat valóban érdekes lenne megvizsgálni, ám sajnos nem találtam cikket arról, hogy valahol is ilyesmit néztek volna. A laborban tartott állatok egyszerűen egy-egy pillanatfelvétel az adott élőlény törzs alapításakori állapotáról. Mint a tárgyalt kísérletek is mutatják, megfelelő szelekciós nyomás hatására villámgyorsan képesek változni a labortörzsek is, egyszerűen azáltal, hogy a nem megfelelő egyedek elpusztulnak, az előnyös mutációkat hordozó egyedek pedig felszaporodnak.
Az értelmes tervezés híveinek egyik gyakori érve a számokkal való bűvészkedés, azt bizonyítván, hogy milyen hihetetlenül kicsi a valószínűsége egyes folyamatoknak. Csak gondolatébresztőnek szánnék néhány adatot: 1 gramm talajban 40 millió baktérium él, azaz 4X107 . Egy öt kilós csomag virágföldben ötezerszer ennyi, azaz 2X1011. Egy kólibaktérium fél óránként képes osztódni megfelelő körülmények között, ez napi 48 nemzedék, de mi vegyünk csak napi hármat. Ez egy év alatt legalább ezer nemzedék, azaz 2X1014 baktérium “születik” egy év alatt egy öt kilós virágföldben. Azért ez szédítően sok. A cikkben emlegetett 10-12 gyakoriságú események százszor történhetnek meg egy átlagos csomag virágföldben egyetlen év alatt, azaz kb. három– négynaponta, a 10-6 gyakoriságú események pedig százmilliószor, azaz kb. másodpercenként háromszor. Egyetlen csomag ötkilós virágföldben. No most a Földön nem öt kiló talaj, és nem is öt liter víz létezik összesen. A Wikipedia szerint egy adott időpillanatban 5X1030 darab baktériumsejt létezik a Földön, akik csak az évi ezer nemzedékkel számolva az utóbbi 3 milliárd évben (3X109) 1,5X1043 –szor osztódtak. Ehhez képest az emlegetett 10-6 és 10-12 esélyek gyermekdednek tűnnek, másodpercenként történnek meg 1030 sejt között.
Ha mondjuk kiszámolnám, hogy mi volt az esélye, hogy az eredeti néhány százmillió spermiumból éppen az az egy termékenyítse meg a petesejtet, amelyekből végül is én jöttem létre – körülbelül 10-8 -, az valószínűtlenné teszi a létezésemet? El kell hogy gondolkodjak rajta, hogy talán nem is élek? Nyilvánvalóan létezek, mert itt állok, tehát a kérdéses esemény valószínűtlensége dacára mégis megtörtént. Ebben az esetben tulajdonképpen mindegy, mi egy adott esemény bekövetkezésének a valószínűsége, mert látjuk, hogy megtörtént. Ugyanígy nem értem, milyen bizonyító ereje van annak, hogy minek mennyi a valószínűsége, ha látjuk, hogy megtörtént?
Tehát összefoglalásként leszögezhetjük, hogy a nejlonszemét emésztésének képessége nem valamilyen hihetetlen módon villanásszerűen keletkezett hirtelen egyszerre három élőlényben, hanem már régóta meglévő fehérjék véletlenszerű mutációs események általi módosulásával. Egy, számos fajban meglévő fehérje néhány apróbb mutációs esemény nyomán képessé vált arra, hogy egy nemrég megjelent táplálékot, a nejlont is megemésszen. Ez nem igényelt semmilyen külső beavatkozást, egyszerűen egy törzsön belüli különböző változatokból előnybe kerültek azok a sejtek, amelyek a “parlagon heverő”, nagy mennyiségben jelen lévő nejlonszemetet is fel tudták használni, mivel ezáltal jelentős mennyiségű táplálékhoz jutottak, így elszaporodhattak. Ez az új tulajdonság több szervezetben is megjelent (Pseudomonas sp., Flavobacterium sp., Achromobacter guttatus), így végképp nem beszélhetünk egyedi, különleges jellemzőkről. Az pedig, hogy egy korhasztó gomba is képes nejlont emészteni, egy módosult ligninbontó enzimjével világosan mutatja, hogyan is történik mindez a természetben, külső beavatkozás és “értelmes tervezés” nélkül is.
Az egyes fehérjéket kódoló gének vizsgálata megvilágította, hogy semmilyen különleges, újszerű, addig nem látott szerkezettel, szerveződéssel, vagy a többi élőlénytől elütő jellemzővel nem bírnak a vizsgált szervezetek. Kijelenthetjük, hogy ebben az esetben értelmes tervezésnek, akaratlagos, tervszerű beavatkozásnak, semmiből megjelenő bonyolult rendszereknek nyoma sincs, egyszerűen a már meglévő természetes változékonyság és a szelekciós nyomás alakította ki a nyilván természetidegen nejlon lebontásának képességét, véletlenszerűen a sejtek néhány töredékszázalékában, minek utána az új tulajdonságot hordozó sejtek előnybe kerültek és elszaporodtak.
Felhasznált források:
Deguchi T., Kitaoka Y., Kakezawa M., Nishida T. (1998): Purification and characterization of a nylon-degrading enzyme; Appl Environ Microbiol. 64(4):1366-71
Kakudo S., Negoro S., Urabe I., Okada H. (1993): Nylon oligomer degradation gene, nylC, on plasmid pOAD2 from a Flavobacterium strain encodes endo-type 6-aminohexanoate oligomer hydrolase: purification and characterization of the nylC gene product; Appl Environ Microbiol 59(11):3978-80.
Kato K., Ohtsuki K., Koda Y., Maekawa T., Yomo T., Negoro S., Urabe I. (1995): A plasmid encoding enzymes for nylon oligomer degradation: nucleotide sequence and analysis of pOAD2; Microbiology 141 ( Pt 10):2585-90
Kato K., Ohtsuki K., Mitsuda H., Yomo T., Negoro S., Urabe I. (1994): Insertion sequence IS6100 on plasmid pOAD2, which degrades nylon oligomers; J Bacteriol 176(4):1197-200
Kinoshita S., Negoro S., Muramatsu M., Bisaria V. S., Sawada S., Okada H., (1977.): 6-Aminohexanoic acid cyclic dimer hydrolase. A new cyclic amide hydrolase produced by Achromobacter guttatus KI74.; Eur J Biochem 80(2):489-95
Kinoshita S., Terada T., Taniguchi T., Takene Y., Masuda S., Matsunaga N., Okada H.(1981): Purification and characterization of 6-aminohexanoic-acid-oligomer hydrolase of Flavobacterium sp. KI72; Eur J Biochem 116(3):547-51.
Negoro S. (2000): Biodegradation of nylon oligomers; Appl Microbiol Biotechnol 54(4):461-6
Matsubara M., Suzuki J., Deguchi T., Miura M., Kitaoka Y. (1996): Characterization of manganese peroxidases from the hyperlignolytic fungus IZU-154; Appl Environ Microbiol.;62(11):4066-72
Negoro S., Shinagawa H., Nakata A., Kinoshita S., Hatozaki T., Okada H. (1980):Plasmid control of 6-aminohexanoic acid cyclic dimer degradation enzymes of Flavobacterium sp. KI72; J Bacteriol 143(1):238-45
Negoro S., Taniguchi T., Kanaoka M., Kimura H., Okada H. (1983):Plasmid-determined enzymatic degradation of nylon oligomers; J Bacteriol 155(1):22-31
Ohno S. (1984): Birth of a unique enzyme from an alternative reading frame of the preexisted, internally repetitious coding sequence; Proc Natl Acad Sci U S A. 81(8):2421-5.
Prijambada I. D., Negoro S., Yomo T., Urabe I. (1995): Emergence of nylon oligomer degradation enzymes in Pseudomonas aeruginosa PAO through experimental evolution; Appl Environ Microbiol. 61(5):2020-2.
Tsuchiya K., Fukuyama S., Kanzaki N., Kanagawa K., Negoro S., Okada H. (1989): High homology between 6-aminohexanoate-cyclic-dimer hydrolases of Flavobacterium and Pseudomonas strains; J Bacteriol. 171(6):3187-91.

Hű!
Eddig is tudtam, hogy a kreacionizmus egy marhaság, grat a cikkhez!
Baktériumok gén, vagy pontmutációja nem bizonyítja, hogy a magasabbrendű szervezeteknél is létezik hasznos genommutáció.
A szelekció a fajt erősíti, nem gyengíti. A mutáció egy DNS károsító jelenség. Hasznosat mutációt még nem találtak.
Ha azonos funkcióra két fehérje is létezik, az a teremtést bizonyítja.
“Itt ugye fölmerül a kérdés,
Nem merül fel.
hogy miért tesz a feltételezett értelmes tervező egy teljesen újonnan tervezett, nyilván rokon nélküli fehérje mellé egy másikat, amely nagy mértékben hasonlít rá, ugyanazt a nejlont bontja, ám kétszázszor rosszabbul működik?”
Mért tervezték meg az Oldsmobilt, amikor egy Mazda, vagy egy Ferrary sokkal jobb.
Ekkora idiótizmust ritkán lát az ember.
“Hasznosat mutációt még nem találtak.”
Ha Te mondod … nyilvan a laktoz-toleranciat okozo mutacio is a szornyen kellemetlen fajtabol valo…
Nemigen érted az evolúciós elméletet.
A HASZNOS mutáció az, amely egy majdani új faj kialakításához keletkezik, és megmarad.
A laktóz tolerancia egy pontmutáció, amely legfeljebb a tejivó FAJTA, popoláció kialakulásához járulhat hozzá.
A laktóz toleranciáért felelős fehérjét alvó gén is előállíthatta. Mivel nem volt rá szükség nem aktiválódott, majd amikor szükség volt rá, működni kezdett.
Ez meg nem mutáció.
Sok felfedezni valót rejteget még a DNS, nem érdemes a mindentudó gőgös szerpében tetszelegni.
ööö, egy Mazda ezek szerint akkor lenne értelmesen tervezett ha egy oldsmobil motorját IS beletervezték volna? Egy Ferrariba meg ha a mazda-motort is beszerelték volna? Igazad van. Ekkora idiotizmust tényleg ritkán lát az ember…
ID_EGEN,
egyikunk valoszinuleg tenyleg nem erti az evolucios elmeletet… Mondjuk szerintem neked a faj keletkezes megertesevel is sulyos gondjaid vannak, ha nem latod/erted az osszefuggest a populacio-specifikus mutaciok megjelenese es a speciacio kozott.
ID_EGEN:
Abban a pár mondtban amit leírsz sok a tévedés.
Kérdés: szerinted mi a mutáció?
Szerintem változás, én egyébként a DNS szintjén gondolom.
Hogy hasznos vagy nem, az pedig nem azon múlik, hogy lesz-e belőle új faj, hanem hogy lesz-e valami pozitív hatása a a hordozó egyedre nézve.
Sorolhatnám a kiigazításokat de nem teszem, inkább annyit kérek, nézz vissza töbször az oldalra és olvasd! 🙂 ( ezt a mamim a bibliára mondja mindíg… )
“Hasznosat mutációt még nem találtak.”
Szerinted a cikk miről szól?
Szvsz inkább te nem érted az evolúciót.
“A HASZNOS mutáció az, amely egy majdani új faj kialakításához keletkezik, és megmarad”
Ez szimplán egy baromság. A természet szempontjából nincs hasznos vagy haszontalan mutáció. Csak mutáció ami változást hoz, és a hogy egy “majdani új faj kialakulásához vezet” nem tudom honnan vetted, de úgy hangzik mintha az ismereteidet az “Evolució” című holywoodi agyrméből vetted volna amiben David Duchovny játszott. A mutációk csak a faj diverzitását növelik, majd a természetes szelekció, gyengébben, vagy környezetváltozás esetén erősebben rostáll. A mutácók, változások sorozata környezettől függően bizonyul hasznosnak, haszontalannak, vagy károsnak, nics olyan, hogy önmaga jogán “hasznos” mutáció. Ami egy környezetben hasznos, egy másikban hátrány lehet, és fordítva.
Egy fajból a másik nem két perc alatt lesz (Ok baktériumok kivételével, akik akár fajok közt is képesek géneket cserélgetni időnként, illetve Neuténia vagy más durva torzulás által létrejött új faj, de az ilyen evolúciós ugrások ritkák és még ritkában sikeresek.) , és egyik mutációnak se nem célja, se nem érdeme önmagában egy új faj kialakulása.