Philip K. Dick, 1968-ban megjelent kultikus regénye, az Álmodnak-e az androidok elektronikus bárányokkal? azt a kérdést feszegeti, hogy éles lehet-e a határ ember és android között, ha pusztán az empátia képességét vizsgáljuk. Ugyanez a probléma fél évszázad után még ugyanúgy a sci-fi kategóriája, mint Dick idejében, de egy analóg kérdés 2017 aktuális problémájává vált. Mégpedig az, hogy milyen morális megítélés alá esnek emberi sejtekből szövetkultúrában létrehozott komplex szövetdarabok, illetve mikortól válik etikailag aggályossá az ezeken való kísérletezés.
Az első organoidok létrehozása, vagyis annak a felismerése, hogy ha egy sejtpopulációt nem egyszerűen síkban növesztünk, hanem megadjuk neki a három dimenzióban való terjeszkedés lehetőségét (meg persze a megfelelő növekedési faktorokat), akkor nagyon komplex, sok tulajdonságukban bizonyos szervekre emlékeztető struktúrák jöhetnek létre, a három évvel ezelőtt tragikus körülmények között elhunyt Josiki Szaszaj nevéhez fűződik.
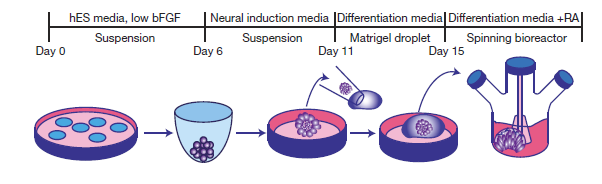
Egy átlagos organoid létrehozásának metodológiája: a sejteket különleges gélekben és pörgő bioreaktorokban tenyésztik, amelyek meggátolják a letapadásukat és elősegítik a 3D-s szerkezet kialakulását. Forrás: Nature
Szaszaj csoportja először szem, majd hipofízis organoidokat hozott létre, és kezdeti áttörésük után alig múlt el hét, amikor valamelyik rangosabb tudományos újság ne hozta volna hírét, hogy újabb és újabb esetben hozták létre adott szerv organoid megfelelőjét embrionális őssejtekből (ESC), vagy újraprogramozott pluripotens sejtekből (iPSC), vagy szöveti őssejtekből. Így aztán ma már tüdő, máj, vastagbél, vese, prosztata, sőt, nyelv organoidról is tud a tudományos irodalom, és persze nem utolsó sorban ún. “mini agy” organoidokról.
Ez utóbbi a Bécsben dolgozó Jürgen Knoblich és csoportja nevéhez fűződik, és azon túl, hogy megdöbbentően összetett, az emberi agykéregre sokban emlékeztető réteges szerkezet jelenlétét igazolták ezekben a pár milliméter átmérőjű szövetlabdákban, rögtön be is mutatták, miképp válhat a jövő orvostudományában nélkülözhetetlenné ez a fajta metodológia. Knoblichék ugyanis nemcsak egészséges emberek sejtjeiből álítottak elő “mini agyakat”, hanem microcepháliában szenvedő betegekéből is, amelyek segítségével szinte azonnal jobban meg lehetett érteni, hogy az általuk hordozott mutáció miképpen okozza az agyi őssejtek osztódásának korai leállását, vagyis a betegségre jellemző kisméretű agyak létrejöttét.
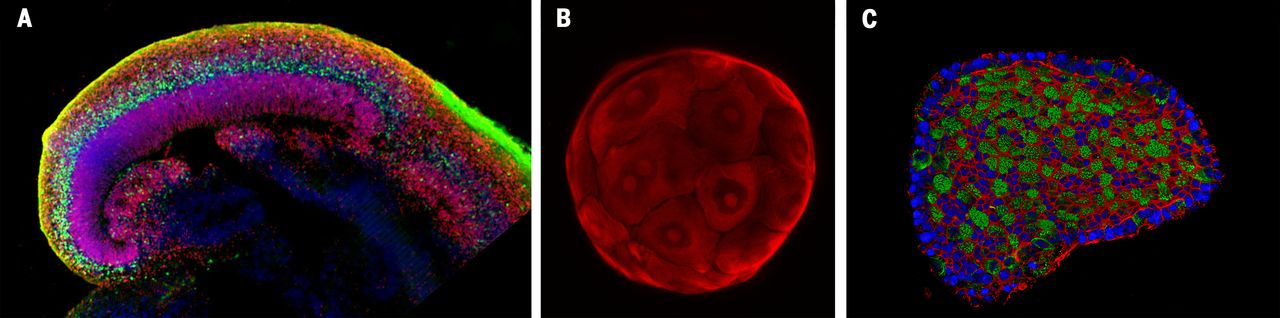
(A) “Mini agy” organoid, (B) máj organoid, illetve (C) légúti sejtekből létrehozott organoid struktúra. Forrás: Science
Ez a fajta betegségmodellezés egyértelműen a legrelevánsabb emberi szempontból, hiszen a szövet az emberi szövet, nem kell esetleges evolúciós különbségekből adódó eltéréseken morfondírozni. (Megj.: van azonban egy fontos dolog, ami miatt az állati modellek nagyon is fontosak maradnak – organoidokon, természetükből adódóan, aligha lehet szisztémás hatásokat vizsgálni.) Szép példa erre, hogy a Zika vírus emberi fejlődésre gyakorolt hatásának megválaszolásánál is kulcsfontosságú volt, amikor tavaly kimutatták, hogy a Zikával fertőzött agy organoidok sokkal kisebbek lesznek – ezzel szinte egyszerre megválaszolódott az addig még kérdésesnek tűnő ok-okozati kapcsolat a várandós anyákat érő vírusfertőzés és a microcephaliás újszülöttek között.
De a betegek saját sejtjeiből készített organoidok nemcsak abban segíthetnek, hogy korábbi ismereteinket kiegészítve jobban megértsük, miképp jön létre egy-egy idegrendszerhez kapcsolódó betegség, hanem hogy valóban személyre szabott terápiákon dolgozhassunk. Bizonyos szerveink esetében (pl. máj) laborban tenyésztett organoidokban fel tudunk olyan sejteket dúsítani, amelyek esetleg a betegben pusztulnak, és vissza tudjuk ültetni őket.
Azzal, hogy mindössze a páciens néhány bőrsejtjéből kiindulva, potenciálisan tucatjával hozhatjuk létre az organoidokat, az is lehetségessé válik, hogy ezt a rengeteg szövetcsomót gyógyszertesztelésre használjuk. Megnézhetjük, hogy melyik gyógyszerek hatnak a legjobban és a legkevesebb mellékhatással a beteg saját sejtjeire (hiszen ezek tk. azok), így jobban meg lehet tervezni, hogy milyen gyógyszereket érdemes adni a páciensnek, hiszen a hatásuk (és mellékhatásuk) jobban előrejelezhető.
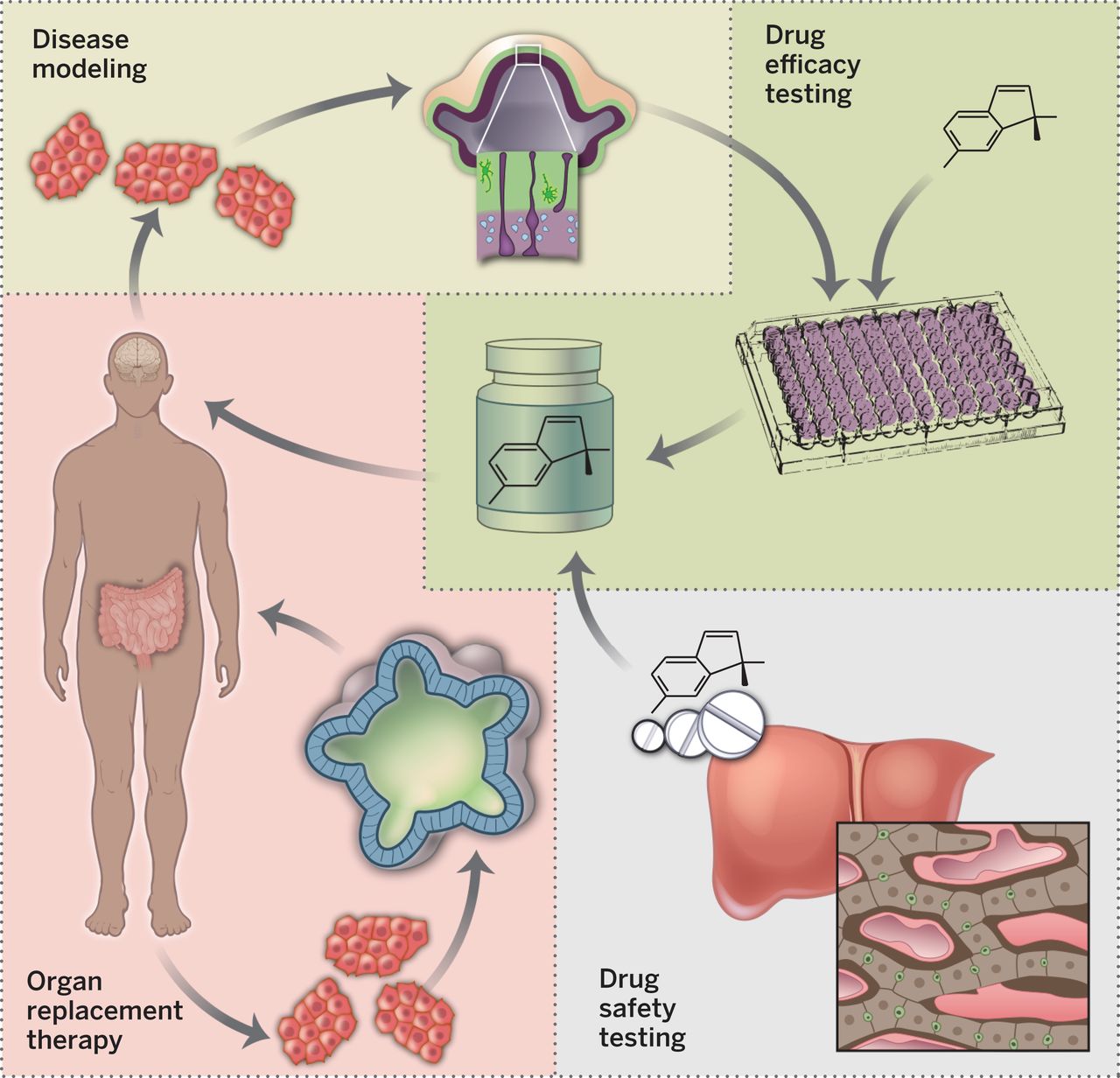
Organoidok segítségével betegségmodellezésre, személyre szabott gyógyszerterápiák meghatározására, illetve transzplantációhoz szükséges szövetek előállítására nyílik lehetőség. Forrás: Science
Mindezek figyelembe vételével talán nem véletlen, hogy nő az organoidok körül a felhajtás és az egyre nagyobb figyelem (meg az ezzel járó anyagi ráfordítás) egyre komplexebb organoidokat fog nyilvánvalóan eredményezni a nem is annyira távoli közeljövőben, amivel egyre pontosabban lehet adott betegek adott betegségét modellezni. Ez viszont olyan kényes etikai kérdések megválaszolását igényli inkább előbb, mint utóbb, amelyek a kísérletes fejlődéstan egyik legkényesebb területéhez, az emberi embriológiához vezetnek.
Az emberi embriókon való kísérletezés etikai szempontból az egyik legszigorúbban szabályozott területe az orvosbiológiának, persze nem véletlenül. Minden emberi kultúra és vallás különleges entitásként kezeli a fejlődő emberi embriót és magzatot, még ha jellegzetes különbségek is adódnak, hogy mikortól tulajdonítanak különleges státuszt neki. Az ábrahámita vallások többsége kb. a 40. naptól tekinti különlegesnek az embriót – érdekesség, hogy a ma legkonzervatívabb (azaz tulajdonképpen a megtermékenytés pillanatát kiemelő) álláspontot képviselő katolikus egyház is ezt gondolta még Aquinói Szent Tamás idején is, és a mai álláspont evolúciójában fontos szerepe volt aztán egy mára már meghaladott nézetnek, a preformacionisták által hirdetett ún. homunculus elméletnek, mely szerint a spermiumok fejében már teljes értékű magzatok bújtak meg. Mindezek a nézetek meghatározóak voltak abban, hogy korábban a humán embriókon való kísérletezés korlátját végül egy konszenzusos 14 napban húzták meg.
Azért pont két hét volt a bűvös határ, mert a normális körülmények között fejlődő embriók ekkor érik el fejlődésük egy kritikus pontját, a primitív csíknak nevezett struktúra megjelenését. Ez az a pont, amikor az embrió addig viszonylag uniform sejtegyvelege végleg szétválik aszerint, hogy melyik sejtekből milyen szövetek jönnek, jöhetnek létre. Így biztosak lehettünk abban is, hogy egy ennél fiatalabb embriónak nem lehet idegszövete sem, és így teljesen kizárt, hogy agyműködésről beszéljünk.
A “14 napos szabály” évtizedekig meghatározó volt – részben azért is, mert nem igazán kérdőjelezte meg semmi, senki nem rendelkezett olyan technológiával, hogy ennyi ideig életben tartson emberi embriókat. A közelmúltban ez azonban változni látszik, ami önmagában még talán nem okozna gondot a szabály szempontjából, ellenben az organoidok léte nyilvánvalóvá teszi a szabályozás ad hoc jellegét és hasznavehetetlenségét az új technológiák fényében.
Az eLife-ban a közelmúltban megjelent hosszú-hosszú véleménycikkben a Harvard kutatói (köztük a leállíthatatlannak tűnő George Church is – különösen fantasztikus egy bevallottan narkolepsziás személy esetében az ilyen produktivitás) hosszasan boncolgatják, hogy a mini agyhoz hasonló valamik, amelyeket ők embrionális jellegekkel rendelkező, szintetikus emberi entitásokként (synthetic human entities with embryo-like features – SHEEF) aposztrofálnak, miért problematikusak az aktuális szabályozás szempontjából, és miért fontos ezeknek a szöveteknek az etikai státuszát minél hamarabb tisztázni.
Ez a felvetés persze nem új, már az első agy organoidok bejelentésekor utaltak rá többen, hogy ez egy tisztázandó kérdés, de mégis ez eddig a legrészletesebb körbejárása a kérdésnek. Mivel organoidok fejlődésekor nem alakul ki primitív csík, illetve két hét alatt a teljes “mini agy” előállítási procedúra lezajlik, a két hetes szabály morfológiai és időbeli kritériumai egyaránt alkalmazhatatlanok. Ugyanakkor pont egy olyan agyszövet jöhet létre a folyamat végén, amit a maga ad hoc jellegével a korábbi szabályozás aggályosnak tartott.
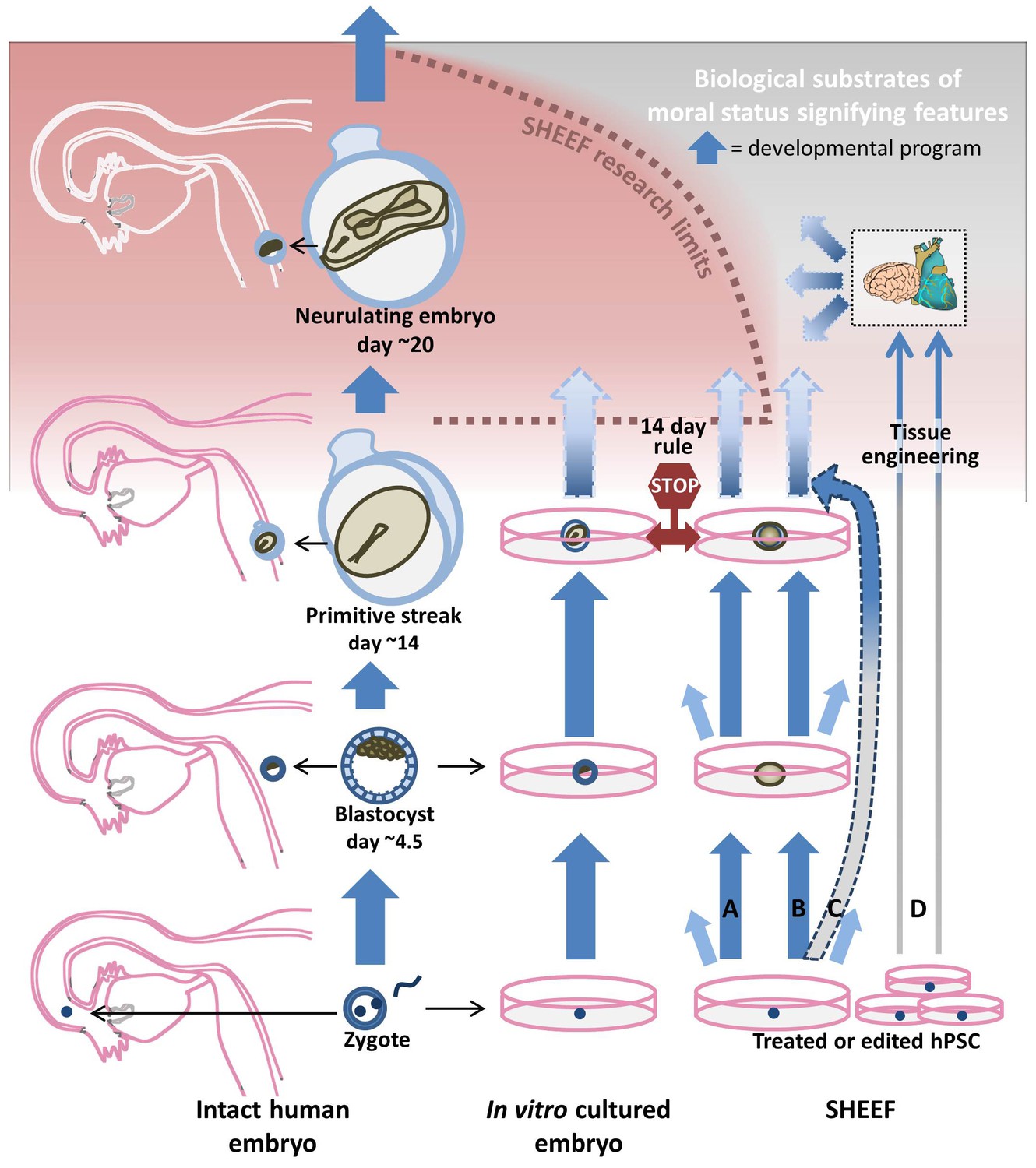
A “14 napos” szabály és értelmezhetősége (vagy értelmezhetetlensége) különböző rendszerekben. Forrás: eLIFE
Természetesen egy “mini agy” összkomplexitás és funkcionalitás szempontjából messze elmarad egy kifejlett emberi agy mögött, de hol húzzuk meg a határt, ahol majd aggódni kezdünk? Egy 4 mm-es agy organoid már összevethető egy egér agyának méretével és elvileg ennél csak komplexebb struktúrákat hoznak majd létre a kutatók a jövőben. Mi lenne, ha egy ilyen SHEEF már részben (vagy akár egészben) a fájdalom feldolgozására való idegsejtek valamilyen hálózatát tartalmazná? Milyen morális státusza lenne egy ilyen organoidnak? Vagy különbözne-e egy egyszerű kétdimenziós szívizomsejt-tenyészet és dobogó szívizomsejtekből álló szívcsővel összekapcsolt “mini agy” morális státusza (utóbbira a nagyobb idegszövet megfelelő oxigén és tápanyagellátása miatt lehet szükség)?
Ez az a dilemma, amire a cikk felhívja a figyelmet. Az ilyen kérdésekre egyelőre nincsenek válaszaink, márpedig nagyon záros határidőn belül kell, hogy legyenek, mert a tudományterület gyors fejlődésével a SHEEF-ek komplexitása is gyorsan növekedni fog. Churchék célja, hogy ne csak felvetődjenek ezek a kérdések, hanem praktikus lépések is történjenek, hogy megnyugtató etikai szabályozás szülessen, amelynek keretében folyjanak a további kísérletek. Biológusok, orvosok és bioetikusok ne külön-külön filozofáljanak ezekről a kérdésekről, hanem együtt fogalmazzanak meg ajánlásokat a politikai döntéshozók számára.
Mert csak így lesz elkerülhető, hogy egy újabb, potenciálisan hasznos technológia demagóg támadások célpontjává váljon.
(Fedőkép forrása: A*, Szingapúr)
[A poszt eredetilega Science Meetup blogjában jelent meg.]
Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, et al. (2013) Cerebral organoids model human brain development and microcephaly. Nature 501(7467):373-9.
Lancaster MA, Knoblich JA. (2014) Organogenesis in a dish: modeling development and disease using organoid technologies. Science 345(6194): 1247125.
Garcez PP, Loiola EC, Madeiro da Costa R, Higa LM, Trindade P, et al. (2016) Zika virus impairs growth in human neurospheres and brain organoids. Science 52(6287):816-8.
Neaves W (2017) The status of the human embryo in various religions. Development 144(14): 2541-2543.
Aach J, Lunshof J, Iyer E, Church GM (2017) Addressing the ethical issues raised by synthetic human entities with embryo-like features. eLife pii: e20674. doi: 10.7554/eLife.20674.
