
Az egyik legelemibb kérdés, amit az aktuális ebola járvány felvet az természetesen egyszerűen az, hogy miért nincs valamilyen hatásos ellenszerünk egy ilyen veszélyes betegség ellen? Mint ahogy a témát feszegető Nature cikk jól összefoglalja a válasz (sajnos) nagyon prózai: mivel a világ szerencsétlenebbik fele volt az utóbbi években csak kitéve a járványnak, a világ szerencsésebbik felén levő nagy gyógyszergyáraknak nem volt prioritása, hogy ellenszert fejlesszenek, azon kevés kutatólaborok pedig, ahol mégis erre adták a fejüket, igazán sosem juthattak el a célvonalig, vagyis a kísérleti vakcináik betegeken való teszteléséig (ui. a helybeliek, különösen most, járvány idején, nagyon bizalmatlanok a “nyugati orvoslással” szemben, így kvázi nincsenek igazán tesztalanyok).
Mindez most változni látszik, hiszen a napokban két amerikai is elkapta a gyilkos kórt és esetükben bevetették a médiában rendre csak “titkos szérum” kódnév alatt futó ZMapp nevű kísérleti vakcinát, amely – egyelőre – úgy tűnik hatásos. A “titkos” jelző itt azonban nem valódi titokra utal, a ZMapp fejlesztője egy MappBio nevű kis cég, akik már hosszabb ideje foglalkoznak vakcinagyártással, így számos publikációjuknak köszönhetően (itt van például egy, számunkra is releváns) elég pontosan tudjuk, hogy miképp is készülhetett a ZMapp.
Ahogy azt az Ars Technica-n is írják, a MappBio egy német eljárást, a magnICON-t licenszel, aminek az a lényege, hogy növényeket, konkrétabban dohányt használnak, hogy specifikus ellenanyagokat hozzanak létre nagy tételben az immunoterápiás kezeléshez. (A részletek iránt sóvárgóknak itt egy részletes review is a növényi-alapú gyógyszer készítésről.) Persze először is egy jól működő, specifikus ellanyagot kell azonosítani, ami szerencsére a HIV-el ellentétben, az ebola vírus esetében nem volt ördöngösen nehéz. A vírus terjedésében kulcsszerepe van a felszínén levő glikoproteinnek, amely fertőzéskor a sejtek felszínéhez tapad és ezt követően juthat be a vírus a sejt belsejébe. Ha tehát olyan ellenanyagot hozunk létre, ami ehhez a glikoproteinhez tapad, és elég nagy tételben adagoljuk, lefedhetjük vele az összes glikoproteint. Márpedig szabad glikoprotein hiányában a vírus egyszerűen képtelen lesz a sejtfelszínhez tapadni, így csökken a fertőzőképesség, ráadásul az ellenanyaggal “megjelölt” vírusokat az immunrendszer felismerheti és elpusztítja.
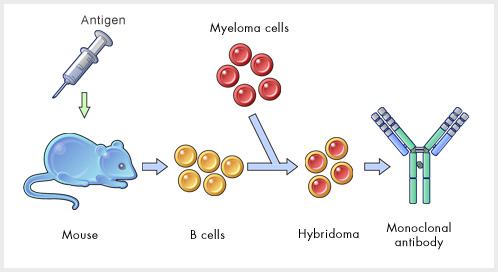 A megfelelő ellenanyag kialakításához előbb egereket fertőztek meg a vírus módosított formájával, majd immunsejteket izoláltak belőlük, amelyeket egyenként örökéletű (és folyamatosan osztódó) ráksejtekkel összeolvasztva, ún. hibridómasejteket hoztak létre. Az ebolával megfertőzött szervezetből származó immunsejtek már elkezdtek különféle egyedi ellananyagokat gyártani, így a fenti módon létrehozott hibridómák gyors vizsgálatával “mindössze” azokra az ellenanyag-termelő sejtekre kellett rátalálni, amelyek a glikoproteinre legspecifikusabb ellenanyagot gyártják. Egy-egy ilyen sejtvonal izolálása után pontosan meg lehetett állapítani, hogy mi a hasznosnak tűnő ellenenyag DNS szekvenciája, majd kis génsebészkedéssel “humanizálni” kellett ezt a nukleinsavdarabot, hiszen egy egér-ellenanyagot emberbe juttatva gyógyulás helyett jó eséllyel súlyos immunreakciót indukálnánk.
A megfelelő ellenanyag kialakításához előbb egereket fertőztek meg a vírus módosított formájával, majd immunsejteket izoláltak belőlük, amelyeket egyenként örökéletű (és folyamatosan osztódó) ráksejtekkel összeolvasztva, ún. hibridómasejteket hoztak létre. Az ebolával megfertőzött szervezetből származó immunsejtek már elkezdtek különféle egyedi ellananyagokat gyártani, így a fenti módon létrehozott hibridómák gyors vizsgálatával “mindössze” azokra az ellenanyag-termelő sejtekre kellett rátalálni, amelyek a glikoproteinre legspecifikusabb ellenanyagot gyártják. Egy-egy ilyen sejtvonal izolálása után pontosan meg lehetett állapítani, hogy mi a hasznosnak tűnő ellenenyag DNS szekvenciája, majd kis génsebészkedéssel “humanizálni” kellett ezt a nukleinsavdarabot, hiszen egy egér-ellenanyagot emberbe juttatva gyógyulás helyett jó eséllyel súlyos immunreakciót indukálnánk.
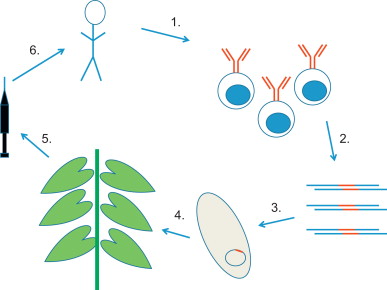 Az így kapott szekvenciát kell végül a dohánynövényekbe juttatni, hogy azok amolyan “bioreaktorként” működve nagy tételben hozhassák létre az immár emberi ellenanyagot. A növénybe, pontosabban a növény levelébe juttatást a növényi transzgenezis kísérletek “málhásszamara”, az Agrobacterium tumefaciens nevű talajlakó baktérium segíti. Először ebbe vitték be az ellenanyagot kódoló DNS szakaszt, majd a baktérium szuszpenziót vákum segítségével juttaták a levelekre. Az Agrobacterium természetes körülmények közt is képes örökítőanyagot juttatni a növényekbe, és most ezt (pontosabban az ezt biztosító DNS darabot) kihasználva a levélsejtekbe juttatható a humanizált ellenanyag kódoló szekvenciája. Itt integrálódik a növényi sejt kromoszómáira és elkezd termelődni az ellenanyag. Kb. hat nappal a fertőzés után jöhet el a “szüret” pillanata, amikor a leveleket begyűjtve el lehet választani az ellenanyagot és az, tisztítás után, máris kész a felhasználásra.
Az így kapott szekvenciát kell végül a dohánynövényekbe juttatni, hogy azok amolyan “bioreaktorként” működve nagy tételben hozhassák létre az immár emberi ellenanyagot. A növénybe, pontosabban a növény levelébe juttatást a növényi transzgenezis kísérletek “málhásszamara”, az Agrobacterium tumefaciens nevű talajlakó baktérium segíti. Először ebbe vitték be az ellenanyagot kódoló DNS szakaszt, majd a baktérium szuszpenziót vákum segítségével juttaták a levelekre. Az Agrobacterium természetes körülmények közt is képes örökítőanyagot juttatni a növényekbe, és most ezt (pontosabban az ezt biztosító DNS darabot) kihasználva a levélsejtekbe juttatható a humanizált ellenanyag kódoló szekvenciája. Itt integrálódik a növényi sejt kromoszómáira és elkezd termelődni az ellenanyag. Kb. hat nappal a fertőzés után jöhet el a “szüret” pillanata, amikor a leveleket begyűjtve el lehet választani az ellenanyagot és az, tisztítás után, máris kész a felhasználásra.
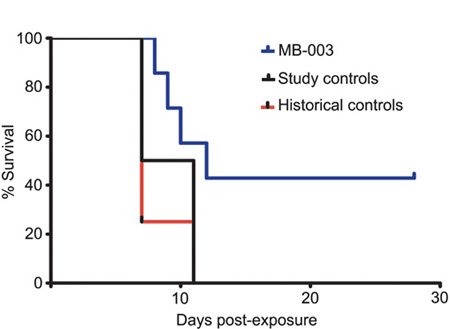 A ZMapp esetében többféle, transzgénikus dohánylevelekben előállított ellenanyagot kombináltak, a nagyobb hatás kedvéért. Ha megnézzük a csoport tavaly, rézusz majmokkal végzett kísérleteit, akkor látható, hogy nem véletlen, hogy ez egy elég hatásos módszer lehet: egy három ellenanyagot tartalmazó koktélt (MB-003) felhasználva, a fertőzött egyedek majd fele életben maradt több mint egy hónappal a fertőzést követően, míg a kontrollok jellemzően 10-11 nappal vírus beadása után mind meghaltak. Hogy ebből mennyire lesz általános ebolakúra az jó kérdés, mindenesetre a WHO már vizsgálja annak a logisztikáját, hogyan lehetne a ZMapp-et és más kísérleti anyagokat Afrikában is tesztelni. A jelek azonban arra mutatnak, hogy nem lesz könnyű.
A ZMapp esetében többféle, transzgénikus dohánylevelekben előállított ellenanyagot kombináltak, a nagyobb hatás kedvéért. Ha megnézzük a csoport tavaly, rézusz majmokkal végzett kísérleteit, akkor látható, hogy nem véletlen, hogy ez egy elég hatásos módszer lehet: egy három ellenanyagot tartalmazó koktélt (MB-003) felhasználva, a fertőzött egyedek majd fele életben maradt több mint egy hónappal a fertőzést követően, míg a kontrollok jellemzően 10-11 nappal vírus beadása után mind meghaltak. Hogy ebből mennyire lesz általános ebolakúra az jó kérdés, mindenesetre a WHO már vizsgálja annak a logisztikáját, hogyan lehetne a ZMapp-et és más kísérleti anyagokat Afrikában is tesztelni. A jelek azonban arra mutatnak, hogy nem lesz könnyű.
