 Az talán már közhely-szintű, hogy az egyes emberi populációk földrajzi elterjedése és bőrszínük változatossága közt a szelekció teremt könnyen megfogható kapcsolatot: a világosabb bőrszín több D vitamin termelést biztosít, de kevésbé véd az UV-B sugárzástól, így csak ott alakulhatott ki, ahol a napsütés kevésbé volt intenzív. Az immunrendszerünk épp olyan jelleg, mint a bőrszín, így ugyanúgy az adott földrajzi környezet körülményei alakítják milyenségét.
Az talán már közhely-szintű, hogy az egyes emberi populációk földrajzi elterjedése és bőrszínük változatossága közt a szelekció teremt könnyen megfogható kapcsolatot: a világosabb bőrszín több D vitamin termelést biztosít, de kevésbé véd az UV-B sugárzástól, így csak ott alakulhatott ki, ahol a napsütés kevésbé volt intenzív. Az immunrendszerünk épp olyan jelleg, mint a bőrszín, így ugyanúgy az adott földrajzi környezet körülményei alakítják milyenségét.
Gondolhatunk itt például arra, hogy attól függően, hol milyen betegségek őshonosak, attól is függ, hogy egyes immungéneknek milyen alléljai gyakoriak. Konkrétabban nem is akármilyen immunogénről van szó, hanem a fő hisztokompatibilitási komplex (MHC) génjeiről. Utóbbiak olyan fehérjéket kódolnak, amelyek az immunsejtek felé képesek a szervezetet támadó patogének darabkáit bemutatni, így aktiválva a sejtes immunválaszt. Az MHC-t kódoló gének a szervezet legpolimorfabbjai közé tartoznak, közer ezer alléljuk ismert és ennek függvényében külön érdekes, ha ilyen-olyan okból egyes területeken egyik, vagy másik allél domináns szerephez jut.
 Az talán már közhely-szintű, hogy az egyes emberi populációk földrajzi elterjedése és bőrszínük változatossága közt a szelekció teremt könnyen megfogható kapcsolatot: a világosabb bőrszín több D vitamin termelést biztosít, de kevésbé véd az UV-B sugárzástól, így csak ott alakulhatott ki, ahol a napsütés kevésbé volt intenzív. Az immunrendszerünk épp olyan jelleg, mint a bőrszín, így ugyanúgy az adott földrajzi környezet körülményei alakítják milyenségét.
Az talán már közhely-szintű, hogy az egyes emberi populációk földrajzi elterjedése és bőrszínük változatossága közt a szelekció teremt könnyen megfogható kapcsolatot: a világosabb bőrszín több D vitamin termelést biztosít, de kevésbé véd az UV-B sugárzástól, így csak ott alakulhatott ki, ahol a napsütés kevésbé volt intenzív. Az immunrendszerünk épp olyan jelleg, mint a bőrszín, így ugyanúgy az adott földrajzi környezet körülményei alakítják milyenségét.
Gondolhatunk itt például arra, hogy attól függően, hol milyen betegségek őshonosak, attól is függ, hogy egyes immungéneknek milyen alléljai gyakoriak. Konkrétabban nem is akármilyen immunogénről van szó, hanem a fő hisztokompatibilitási komplex (MHC) génjeiről. Utóbbiak olyan fehérjéket kódolnak, amelyek az immunsejtek felé képesek a szervezetet támadó patogének darabkáit bemutatni, így aktiválva a sejtes immunválaszt. Az MHC-t kódoló gének a szervezet legpolimorfabbjai közé tartoznak, közer ezer alléljuk ismert és ennek függvényében külön érdekes, ha ilyen-olyan okból egyes területeken egyik, vagy másik allél domináns szerephez jut.
 Ha azonban őszinték vagyunk, a fent körvonalozott, betegség és alléleloszlás közti összefüggést magyarázó, logikusnak hangzó eszmefuttatás csak egy elmlélet (na persze nem kreacionista értelemben vett…), aminek gyakorlati bizonyítása nem annyira egyszerű. Mert hiszen mi csak a ma észlelt alléleloszlásból tudunk extrapolálni, hogy miként is alakulhatott ki az. Élőben megfigyelni az egyes humán allélok eloszlásának kialakulását macerás lenne (na meg jól kontrollált kísérletet emberi populációban etikai okok miatt sem lenne könnyű csinálni), de szerencsére megfelelő modellszervezetek birtokában az elmélet esszenciáját tesztelni tudjuk.
Ha azonban őszinték vagyunk, a fent körvonalozott, betegség és alléleloszlás közti összefüggést magyarázó, logikusnak hangzó eszmefuttatás csak egy elmlélet (na persze nem kreacionista értelemben vett…), aminek gyakorlati bizonyítása nem annyira egyszerű. Mert hiszen mi csak a ma észlelt alléleloszlásból tudunk extrapolálni, hogy miként is alakulhatott ki az. Élőben megfigyelni az egyes humán allélok eloszlásának kialakulását macerás lenne (na meg jól kontrollált kísérletet emberi populációban etikai okok miatt sem lenne könnyű csinálni), de szerencsére megfelelő modellszervezetek birtokában az elmélet esszenciáját tesztelni tudjuk.
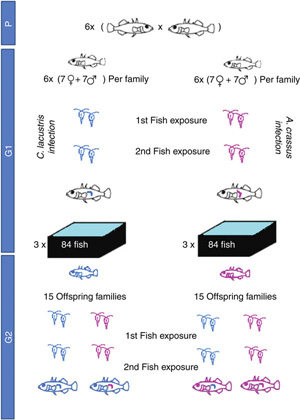
Mindehhez nincs másra szükség, mint egy méretes és viszonylag homogén tüskés pikó populációra, amit két részre osztunk, és a két párhuzamos populációt különböző parazitákkal boldogítjuk (C. lacustris ill. A. crassus).
A két hullámban végrehajtott fertőzés után mindkét kísérleti populációt ívatjuk, majd utódaikat felnevelve két kérdésre keressük a választ: megváltozik-e az MHC gének alléleloszlása a szülőkhöz képest, valamint a szülők “előkezelése” adott parazitával okoz-e egyfajta indirekt rezisztenciát az utódokban.
Nos, a jelek arra utalnak, hogy mindkét válasz igenlő. A két kísérleti populációban egy-egy MHC allél szignifikánsan gyakoribb lett, mint a szülőkben (lásd alább, balra)és ez nem tekinthető puszta véletlennek, hiszen közben más, semleges gének esetében nem lehetett ennyire egyértelmű allélgyakoriság eltolódást észlelni.
Mindenközben, ha a szülők által is megtapasztalt parazitákkal boldogítottuk őket, az utódok kevésbé lettek fertőzöttek, mint azok a társaik, akiknek szülei nem találkoztak a vizsgált élősködővel (alább, jobbra).
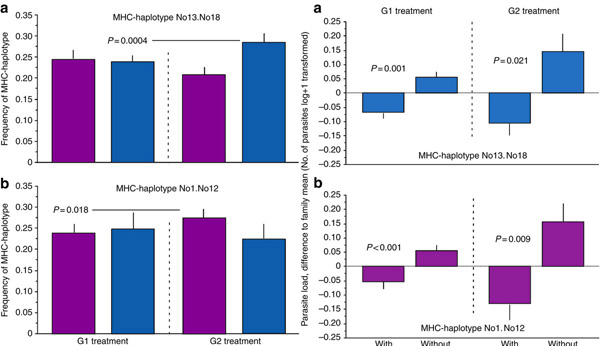
Mi is következik ebből? Hogy azok a nőstények és hímek, akik a parazitával szemben valamilyen fokú rezisztenciát élveztek MHC alléljuknak köszönhetően, sikeresebben szaporodtak és adták át génjeiket a következő populációnak. A siker oka lehet, hogy a fertőzést kevésbé megsínylő nőstények több petesejtet tudtak létrehozni, és/vagy a rezisztensebb allélt tulajdonló hímek egészségesebbek, fittebbek voltak mint társaik, így a nőstények nagyobb valószínűséggel választották őket a párzás során.
Mint látható egyetlen generáció elegendő, hogy a pikók természetes populációiban levő nagyszámú MHC allél közt arány-eltolódást okozzon és nincs okunk azt feltételezni, hogy mindez emeberekben nagyon másképp történne.
Eizaguirre C, Lenz TL, Kalbe M, Milinski M (2012) Rapid and adaptive evolution of MHC genes under parasite selection in experimental vertebrate populations. Nature Communications 3: 621, doi:10.1038/ncomms1632

Remek cikk. Egy apró pontosítás: nem hiszton-, hanem hisztokompatibilitási komplex.
Bocsánat, szégyenteljesen amatőr hiba. Javítva.
Remélem jól értelmezem az eredményt.A tüskés pikók ezek szerint mindkét fonálféreg fajjal szemben sikeresen kialakították a rezisztenciájukat, tehát innentől kezdve ezekkel a fajokkal szemben genetikai védelemre tettek szert.A végkövetkeztetés pedig az, hogy az emberek és az én értelmezésem szerint talán más állatfajok is képesek genetikai rezisztenciával rendelkezni fonálféreg fajokkal szemben. Ez a számomra azért meglepő mert még nem hallottam olyat, hogy pl.a Trichinella spiralis(borsóférgesség), a Taenia multiceps(kergekór) vagy a Fasciola hepotica(májmétely)férgekkel szemben alakult volna ki természetes úton rezisztencia, pedig erre több tízezer éven keresztül amióta a háziállatok nemesítése tart bőven lett volna lehetőség.Persze az is lehet, hogy az én ismereteim nem tartottak lépést a tudományos élet eredményeivel.
Nem teljesen váltak rezisztenssé, hanem csak bizonyos mértékben, vagyis itt arányokat figyelünk. Mivel nagyon sok állat már egyébként (vad formájában is) is olyan környezetben élt, ahol összefuthattak ezekkel a parazitákkal, nem vagyok biztos benne, hogy nagyon nagy fokú különbséget várhatunk a nem szelidített és szelíd populciók között.