 Ha ember, baktérium és géntranszfer szerepel egy hírben, akkor szinte biztosak lehetünk benne, hogy a genetikai anyag áramlása a prokarióta felől történt. De azért ennek a területnek is megvannak a maga “ember harapott kutyába” történetei, amikor nem a kézenfekvőnek tűnő esemény következik be.
Ha ember, baktérium és géntranszfer szerepel egy hírben, akkor szinte biztosak lehetünk benne, hogy a genetikai anyag áramlása a prokarióta felől történt. De azért ennek a területnek is megvannak a maga “ember harapott kutyába” történetei, amikor nem a kézenfekvőnek tűnő esemény következik be.
A trippert okozó Neisseria gonorrhoeae-től egyébként sem áll messze a fertőzés, ám kivételesen most mégis egy olyan esetről írnék, amikor kvázi humán gazdája “fertőzte” meg a kórokozót. A “fertőzés” tárgya ez emberi genomban rengeteg példányban előforduló L1 transzpozon, ugyanis ennek egy darabjának jelenlétét sikerült kimutatni több N. gonorrhoeae izolátumból.
A LINE ugrálóelemek közé tartozó L1 standard körülmények között csak eukarióta genomokban garázdálkodik, ahol jó retrotranszpozonhoz illően, önmagát sokszorosítja RNS kópiák és azokat DNS-re visszaíró reverz transzkriptáz enzimek segítségével. Ennek megfelelően olyan DNS szakaszt találni, ami egyértelműen L1 eredetű, egy prokariótában finoman szólva sem triviális.
 Ha ember, baktérium és géntranszfer szerepel egy hírben, akkor szinte biztosak lehetünk benne, hogy a genetikai anyag áramlása a prokarióta felől történt. De azért ennek a területnek is megvannak a maga “ember harapott kutyába” történetei, amikor nem a kézenfekvőnek tűnő esemény következik be.
Ha ember, baktérium és géntranszfer szerepel egy hírben, akkor szinte biztosak lehetünk benne, hogy a genetikai anyag áramlása a prokarióta felől történt. De azért ennek a területnek is megvannak a maga “ember harapott kutyába” történetei, amikor nem a kézenfekvőnek tűnő esemény következik be.
A trippert okozó Neisseria gonorrhoeae-től egyébként sem áll messze a fertőzés, ám kivételesen most mégis egy olyan esetről írnék, amikor kvázi humán gazdája “fertőzte” meg a kórokozót. A “fertőzés” tárgya ez emberi genomban rengeteg példányban előforduló L1 transzpozon, ugyanis ennek egy darabjának jelenlétét sikerült kimutatni több N. gonorrhoeae izolátumból.
A LINE ugrálóelemek közé tartozó L1 standard körülmények között csak eukarióta genomokban garázdálkodik, ahol jó retrotranszpozonhoz illően, önmagát sokszorosítja RNS kópiák és azokat DNS-re visszaíró reverz transzkriptáz enzimek segítségével. Ennek megfelelően olyan DNS szakaszt találni, ami egyértelműen L1 eredetű, egy prokariótában finoman szólva sem triviális.
A leírt esetet az alábbi ábra magyarázgatja meg, ahol az (A) panelen egy L1 elem sematikus szerkezete látható, (B)-n a szóbanforgó, L1 eredetű szekvencia (erre nL1-ként utalnak a cikk szerzői), végül a (C) panelen a Neisseria genomjának azon pozíciója, ahova az inszerció történt.
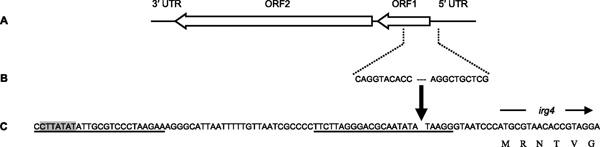 Érdekes a történetben, hogy igazából csak néhány N. gonorrhoeae izolátum hordozza az nL1-t, ami arra utal, hogy a DNS beépülése a relatív közelmúltban történhetett.
Érdekes a történetben, hogy igazából csak néhány N. gonorrhoeae izolátum hordozza az nL1-t, ami arra utal, hogy a DNS beépülése a relatív közelmúltban történhetett.
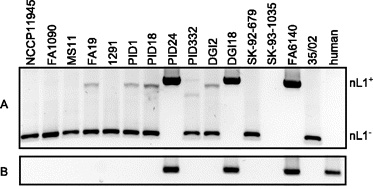 A mellékelt PCR eredménye is mutatja, hogy, ha az nL1-et határoló szakaszok közti genomi régiót akarjuk felszaporítani, akkor a legtöbb izolátumban egy viszonylag rövid DNS darab keletkezik (nL1–) és csak három esetben leljük nyomát egy kb 700 bázispár hosszú inszerciónak (nL1+). Hogy utóbbi identitása se legyen kérdéses, L1 specifikus szekvenciaként azonosítható, ezt mutatja a (B) panel, ahol a humán minta szolgál pozitív kontrollként.
A mellékelt PCR eredménye is mutatja, hogy, ha az nL1-et határoló szakaszok közti genomi régiót akarjuk felszaporítani, akkor a legtöbb izolátumban egy viszonylag rövid DNS darab keletkezik (nL1–) és csak három esetben leljük nyomát egy kb 700 bázispár hosszú inszerciónak (nL1+). Hogy utóbbi identitása se legyen kérdéses, L1 specifikus szekvenciaként azonosítható, ezt mutatja a (B) panel, ahol a humán minta szolgál pozitív kontrollként.
Hogyan jutott az L1 a baktériumba? A pontos mechanizmus nem világos, de az szinte biztos, hogy nem reverz transzrkipcióval, hiszen akkor egy teljes L1 kópia kellene jelen legyen. Inkább arról lehet szó, hogy ezek baktériumok előszeretettel vesznek fel a környezetükből DNS darabokat, hiszen ezzel sokkal gyorsabban lehet új, potenciálisan hasznos szekvenciákhoz jutni, mint a fáradtságos klasszikus mutációkkal. Egy embert fertőző baktériumba pedig bejutott egy L1 darabka (pl. egy pusztuló sejtnek a fragmentálódó DNS-éből), ami sikeresen beépült.
Az érdekes kérdés persze, hogy mindez egy véletlen és csak idő kérdése, hogy az nL1 elvesszen, vagy esetleg jelenléte valami előnyt biztosít hordozójának. Erre sajnos még nem derült fény, de remélhetőleg, ami késik, nem múlik
Anderson MT, Seifert HS. (2011) Opportunity and means: horizontal gene transfer from the human host to a bacterial pathogen. MBio 2(1) pii: e00005-11. doi: 10.1128/mBio.00005-11.
