Az első dolog, ami feltűnt Borgny Egelandnak, hogy egyébként teljesen egészségesnek tűnő kislányának, Livnek furcsa illata volt: az istállóra emlékeztető szag áradt a hajból, a bőrből, de még a vizeletből is. Aztán teltek, múltak az évek és a kislány háromévesen sem mondott egyetlen szót sem. Először senki nem aggódott, de ez később sem változott meg. Borgny második gyereke Dag, szintén hasonló tüneteket mutatott: a szag és a beszédképtelenség mindkét Egeland gyereket sújtotta. Hosszú időbe telt, amíg egy orvos, Asbjørn Følling egyáltalán szisztematikusan elkezdte vizsgálni, hogy a két tünet összefügg-e.
A kor (1934-et írunk) egyik tipikus tesztjével, a vasklorid teszttel először annak ment utána, hogy nem valami különös cukorbetegség okozza a tüneteket: akkor már tudták, hogy cukorbetegekben a vas(III)-klorid hatására a vizelet lila színűvé változik. Liv és Dag vizelete azonban zöld lett – ezt még se Følling, se más nem tapasztalt soha. Hosszas irodalmazás és kutatás (valamint 22 liternyi Egeland-gyerek vizelet) után derült ki a betegség oka: egy különleges genetikai mutáció miatt a gyerekek szervezete képtelen volt lebontani a fenilalanin nevű aminosavat, ami felhalmozódva elkezdte az idegrendszert roncsolni. Ez volt az egyik első genetikai anyagcsere-betegség, ma fenilketonuiraként (PKU) ismerjük. (Megj.: a PKU felfedezésének sokkal részletesebb történetét Carl Zimmer új könyvében mindenki elolvashatja.)
A probléma felismerése aztán elvezetett egy kellemetlen, de mindmáig használatos gyógymódhoz, ahol a betegek táplálékát módosítják úgy, hogy minimális fenilalanint tartalmazzon – azaz egy alapvetően fehérjeszegény diétáról van szó, amit nem egyszerű tűzön-vizen át betartani, főleg egy életen keresztül.
Persze nyilván az is megoldás lenne, ha valamiképpen a lebontásért felelős enzimet (amit nem termel a hibás gén) pótolnák a betegekbe vissza és ennek megfelelően folyamatban vannak génterápiás kísérletek (viszont, ha lesznek is engedélyezettek majd ilyenek, már most látjuk, hogy igen borsos áruk lesz), és már sok évvel ezelőtt próbálkoztak szájon át bejuttatni szintetikusan előállított fenilalnin-bontó enzimeket (pl. fenilalanin ammónia-liáz (PAL)), de az előállítás sokkal bonyolultabb és drágább lett, mint az etalonnak számító inzulin esetében, így ezek a próbálkozások is elhaltak.
A szintetikus-biológiába hajló mikrobiális genetikának köszönhetően azonban adja magát egy másik megoldás is: a tiszta enzim helyett olyan baktériumokat visznek be, melyek a mikrobiótába beépülve felveszik és lebontják a fenilalanint.
Ilyen baktérium alapból nincs, de azért néhány enzim hozzáadásával lehet csinálni. És itt jön képbe a Synlogic cég SYNB1618 névre hallgató E. coli törzse. Az E. coli egyébként is jó választás, hiszen természetes résztvevője a bélflóránknak, és a Synlogic ebbe a baktériumba két fenilalanin lebontási útvonalat is beépített: egyrészt a bacik kifejezik a citoplazmatikus PAL enzimet (és hogy az aminosav bekerüljön egy nagyon hatékony PheP névre hallgató transzportert is), másrészt a membránhoz kötött L-aminosav deaminázt (LAAD), ami a fenilalaninból fenilpiruvátot csinál.
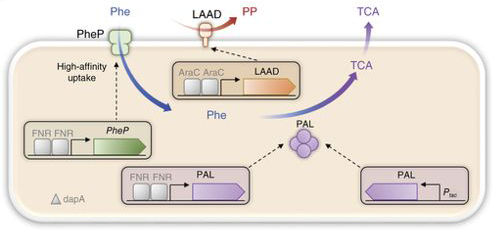
A trükk még annyi, hogy a baci csak az emberi bélrendszer oxigénszegény környezetében kezdi átírni ezeknek a fehérjéknek a génjeit (vagyis olyan szabályozó szekvenciákhoz kötötték őket, amelyeket az oxigén hiány aktivál).
Elméletileg jól hangzik, de vajon egy élő rendszerben megállná-e a helyét a szintetikus biológiával előállított élő “gyógyszer”? Ennek első próbája PKU-modell egerekben történt (ahol szintén a fenilalnin lebontásáért felelős útvonal egyik génje hibás): a beteg egereknek vagy SYNB1618-t adtak, vagy kontrollként sima E. coli-t, majd a bőrük alá fenilalanint juttattak és nézték, a vérükben hogyan változik az aminosav mennyisége.
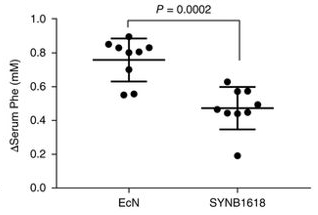 Amint az a baloldali grafikonon is jól látszik, a SYNB1618 hatására közel 38%-ban csökkent a fenilalanin szintje a mutáns egerek vérplazmájában, ami kellően nagy hatás volt ahhoz, hogy a klinikai alkalmazást is megfontolják.
Amint az a baloldali grafikonon is jól látszik, a SYNB1618 hatására közel 38%-ban csökkent a fenilalanin szintje a mutáns egerek vérplazmájában, ami kellően nagy hatás volt ahhoz, hogy a klinikai alkalmazást is megfontolják.
Utóbbi előszobája persze egy főemlős (konkrétan makákó) kísérletsorozat volt, ahol szintén jól muzsikált a szer és ha a tegnap megszellőztetett híreknek hinni lehet, akkor egyelőre az első fázison át is ment a szer, így figyelhetjük, hogy az emberi PKU betegekben is kellő hatást lehet-e vele elérni.
Most akkor minden tele lesz majd transzgénikus, fenilalanin lebontó bacikkal, hiszen a betegekből előbb utóbb azok kikerülnek? A válasz első közelítésben az, hogy nem, ui. a Syngenta kutatói arra is gondoltak, hogy olyan élőlényt hozzanak létre, ami a szabadban nem nagyon tud életben maradni. Ehhez a baktérium saját anyagcseréjébe is beleszóltak: a dapA nevű gén kitörlésével a SYNB1618 egy olyan törzs lett, ami képtelen sejtfalat szintetizálni, ha nem tápláljuk mesterségesen diaminopimeláttal (DAP). Ami persze azt is jelenti, hogy a DAP-ot max. nyomokban tartalmazó bélben sem tud sokáig fennmaradni, de mivel a baktériumok fenntartása és szaporítása olcsón megoldható, ez nem nagy gond. A betegeknek egyszerűen naponta – két naponta kellene egy-egy kapszulányi “élő flórás” gyógyszert lenyelniük az utánpótláshoz.
Isabella VM, Ha BN, Castillo MJ, Lubkowicz DJ, Rowe SE, at al. (2018) Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nat Biotechnol doi: 10.1038/nbt.4222.

Nagyon erdekes. Azt nem ertem, hogy a kiseletben bor ala adott (vagy a gyakorlatban a taplalekbol mar egyszer a vekonybelben felszivodott) fenilalanin hogyan jut el a vastagbelben tanyazo lebonto bakteriumokhoz?