Szenzáció! Lebukott a BRCA1! Most fény derül minden titokra! Helyszíni tudósítónktól Ön is megtudhatja, hogy mi áll a BRCA1 és a mell- illetve petefészekrák titkos kapcsolata mögött!
Elnézést, egy csöppet elragadtattam magam.
Az elhíresült Angelina Jolie-hír kapcsán mindenki a BRCA-génekkel van mostanában elfoglalva, amelyek közül a BRCA1, mint azt dolphin Szendi-kritikájából is megtudhatjuk, egy DNS-hibajavításban részt vevő fontos tumorszupresszor fehérjét kódol. Ha az ember lánya egy mutáns allélt hordoz a BRCA1 lókuszán, nagy eséllyel (60-85%) alakul ki nála élete folyamán mell-és petefészekrák. Ha az ember jobban belegondol mindebbe, jogosan felmerül a kérdés, hogy ha egy alapvetően fontos hibajavító fehérjéről van szó, ami minden sejtben jelen van, miért csak a mellben és a petefészekben hoz létre ilyen nagy valószínűséggel rákot? Miért főként nőket érint a dolog? Logikus válasz erre a kérdésre az lenne, hogy hormonális okok állnak a háttérben, de kétlem, hogy a DNS-hibajavítás és a hormonok között valaha is közvetlen összefüggést sikerülne találni. Na de akkor most mi is a helyzet? Akkor nincs is köze az egésznek a BRCA1 fehérjéhez?
A válasz természetesen az, hogy igenis van köze az 1994-ben felfedezett génnek az öröklődő mell- és petefészekrákhoz (a BRCA1-mutációk felelősek az öröklődő mellrákok feléért és az öröklődő mell- és petefészekrákok 80-90%-áért), de a helyzet egy csöppet bonyolultabb annál, mint hogy a tumorszupresszor fehérje elveszti funkcióját vagy lecsökken az expressziója, és ezáltal a sejtek elkezdenek kontroll és hibajavítás nélkül osztódni. Az igaz ugyan, hogy a BRCA1-pozitív rákos sejtekben lezajlik a heterozigócia elvesztése nevű folyamat (LOH – loss of heterozygocity), ami szimplán azt jelenti, hogy a sejtekben a vad típusú, vagyis a még működőképes fehérjét kódoló allél valamilyen módon elveszett, és csak a mutáns allél maradt meg, ami a tumorszupresszor fehérjékre igencsak jellemző, ám a sporadikus, vagyis a nem öröklött mell- és petefészekrákos betegekben a rákos sejtek csak ritkán tartalmaznak BRCA1-mutációt. Ez utóbbi jelenség viszont igencsak furcsa, hiszen számos más tumorszupresszor (például p53, Rb) esetén az öröklött és a sporadikus tumorok között nincs ilyen különbség.
A BRCA1-nek van a DNS-hibajavításon túl egy másik, esetünkben igencsak fontos funkciója is: más gének expresszióját szabályozza. Jó, tudom, mindenkinek maga felé hajlik a keze, az én mániám a génexpresszió-szabályzás, mondhatni, hogy ha jobban beleásom magam egy adott fehérjéről szerzett ismeretanyagba, biztos találok valami izgalmas cisz-reguláló sztorit. Nos, esetünkben is ez történt, de ez most tényleg fontos, ugyanis ez ad választ a fenti kérdésekre.
A BRCA1-ról kimutatták, hogy képes a gének átírását végző RNS polimeráz II holoenzimmel kapcsolatba lépni, ami transzkripciós reguláló szerepet sugall. Ez a szerep be is igazolódott, ha expressziós rendszerekben aktiválták, különböző géneket volt képes ki- illetve bekapcsolni. A pozitív és negatív szabályozó szerepét kimutatták in vitro transzkripciós rendszerekben is, bár kiderült, hogy maga a BRCA1 nem szekvencia-specifikus DNS-kötő fehérje. A génexpressziót szabályozó funkciója így közvetett, szekvenciaspecifikus transzkripciós faktorokkal való kölcsönhatás révén valósul meg.
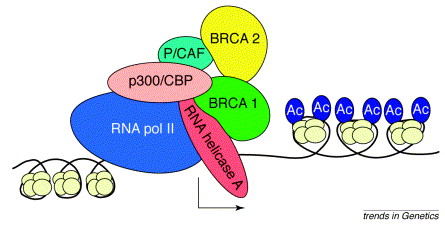
A BRCA1 által szabályozott gének között vannak a ligandaktivált ösztrogén receptor (ER-alfa) által szabályozott gének (köztük a pS2 és katepszinD is), illetve maga az ER-alfa is. Ezeket a géneket a BRCA1 represszálja, vagyis a gének expressziójára negatív hatással van, és az ösztrogén receptor esetében ez a hatáshoz ösztrogén sem szükséges. Hurrá, megvan a hiányzó kapocs a BRCA1 és a nem- illetve szervspecifikus tumorképzés között: ha hibás a BRCA1, több az ösztrogén receptor a sejtekben. Ebben az érvelésben sajnos csak egy „aprócska” probléma adódik, méghozzá az, hogy ezek a mell- és petefészek-tumorok az esetek nagy többségében nem expresszálnak ER-alfát. Különböző egér-kísérletek alapján azt feltételezik, hogy a BRCA1-deficiens rákos sejtek először még termelik a kérdéses ösztrogén receptort, ám a rákos transzformáció egyik későbbi stádiumában egyes sejtek ösztrogénfüggetlenné válnak, és ezek szaporodnak el. Ennek az lehet az oka, hogy míg a BRCA1 gátolja az ER-alfa expresszióját, az ER-alfa aktiválja a BRCA1 átíródását. Vagyis azok a sejtek, amelyek termelik az ösztrogén receptort, jobb DNS-hibajavító mechanizmussal rendelkeznek, ha a vad típusú BRCA1-allél még jelen van a genomban, így a már kialakult rákos sejtek közül azok tudnak gyorsabban elszaporodni, amelyek kikapcsolják az ösztrogén receptor termelését.
Az ösztrogén receptor és az ösztrogén jelátviteli pálya egyéb komponenseinek expresszióján kívül a BRCA1 az ösztrogén termelődésében kulcsszerepet játszó egyik enzim átíródását is szabályozza.
A női szervezetben keringő ösztrogént elsősorban a petefészek granulóza sejtjeiben termelődő aromatáz enzim állítja elő androgénből. A petefészki aromatáz szigorú sejttípus- és fejlődési stádium függő expresszióval rendelkezik. A különféle sejttípusokban különböző promóterek aktívak. Egeken és emberi sejtvonalakon végzett kísérletek inverz korrelációt mutattak ki a granulóza sejtekben az aromatáz és a BRCA1 expresszió között. Ezek szerint azok az aromatáztermelő sejtek, amelyekben a BRCA1 inaktiválódott, több ösztrogént termelnek, mint azok, amelyikben csak a vad típusú BRCA1 fehérje jelen van. Így azok a nőknek, akikben funkcióképtelen BRCA1 allél van jelen a genomjában, magasabb alap ösztrogénszinttel rendelkeznek a reproduktív éveik alatt.
Ez a hosszú távú emelkedett ösztrogénszint, valamint a magasabb ösztrogén receptor mennyiség tehető felelőssé azért, hogy a BRCA1 mutációt hordozó nőkben nagyobb eséllyel alakul ki mellrák és petefészekrák.
Mindezek alapján már érthető, hogy miért jelent a BRCA1 genetikai hibája nagyobb rákkockázatot nőknél, mint férfiaknál, és értelmet nyer az is, hogy egy minden sejtben jelen levő tumorszupresszor fehérje hibájához miért pont a mell – és petefészekrák kapcsolódik. És remélem az is világossá vált sokak számára, hogy ezek alapján irreleváns, mennyi D-vitamint is eszik az, akinek pozitív lett a BRCA-tesztje.
* A BRCA-pozitivitás jelen esetben azt jelenti, hogy az adott sejtek mutáns BRCA-allélt tartalmaznak.
Yanfen Hu, BRCA1, Hormone, and Tissue-Specific Tumor Suppression Int J Biol Sci 2009; 5(1):20-27.

Ha jól értem, hosszas elmélkedés és kísérleti eredmények után végülis sikerült itt egy lehetséges ok-okozati útvonalat találni. De ennek a mértéke a kérdés mindig. Hogy állunk annak a kísérletes bizonyításával, hogy tényleg az ismertetett útvonal a mérvadó és “elégséges” nem pedig más? Ha pedig megvan ez az útvonal, akkor hogyan állunk a lehetséges megelőzési metódusokkal? Valóban csak az eltávolítás a megoldás? Más ötletek nincsenek? A fenti információk alapján azért lehetnének még ötletek szép számmal, nem?
@G.M.E.:
Tudtommal nincs erre kísérlet, hogy pontosan hogyan alakul ki a BRCA1 mutációját hordozókban a mell- illetve petefészekrák. Az idézet cikk egy review, ami összefoglalja a témában megjelent eddigi eredményeket.
Nem igazán vagyok otthon a gyógyszergyárak régebbi illetve fejlesztés alatt levő termékeiben, de sejtésem szerint nem olyan egyszerű egy ösztrogén receptor szintet finomhangolni vagy egy hormonszintet beállítani.
Más megelőzési módszer nem igazán jut eszembe, és szerintem az eltávolítás eléggé rutineljárásnak számít. Pláne, hogy az implantáció külön nagy iparág.