 A nap, amikor 1928-ban, a londoni St. Mary’s kórház földszinti laboratóriumában Fleming felfedezte a penicillint, egyértelműen az emberiség közegészségügyének piros betűs ünnepe lehetne. Kevés dolog felelős ennyire egyértelműen emberek millióinak életben maradásáért, épp ezért érthető a fokozódó aggodalom a legkülönfélébb antibiotikumoknak ellenálló “szuper-rezisztens” baktérium törzsek megjelenéséért. Amennyire megítélhetjük a 19. századi beszámolókból, ezeknek a multi-rezisztens törzseknek a széles körű elterjedése lassan egy évszázada elfeledett nyomorúságot hozna ránk.
A nap, amikor 1928-ban, a londoni St. Mary’s kórház földszinti laboratóriumában Fleming felfedezte a penicillint, egyértelműen az emberiség közegészségügyének piros betűs ünnepe lehetne. Kevés dolog felelős ennyire egyértelműen emberek millióinak életben maradásáért, épp ezért érthető a fokozódó aggodalom a legkülönfélébb antibiotikumoknak ellenálló “szuper-rezisztens” baktérium törzsek megjelenéséért. Amennyire megítélhetjük a 19. századi beszámolókból, ezeknek a multi-rezisztens törzseknek a széles körű elterjedése lassan egy évszázada elfeledett nyomorúságot hozna ránk.
A rezisztencia elterjedéséért, ma már tudjuk sokban felelős a szakszerűtlen és felelőtlen antibiotikum szedés, de magának a rezisztencia eredetéről kevesebbet esik szó.
Ez minden valószínűség szerint nem helyén való, hiszen (számos más tényező mellett) ennek is tulajdonítható, hogy mégoly lelkes zöld aktivisták is badarságokat beszélnek, amikor az antibiotikum-rezisztencia szóba kerül.
 Fleming felfedezésekor ez triviálisabbnak tűnhetett, de a főbb antibiotikumjaink mind természetes eredetűek. Gombák és baktériumok termelik a más baktériumok elleni folyatott evolúciós küzdelem során. És persze ennek megfelelően, az evolúciós fegyverkezési versenyek logikájából kifolyólag, a rezisztencia is a természetes populációkban jelent meg.
Fleming felfedezésekor ez triviálisabbnak tűnhetett, de a főbb antibiotikumjaink mind természetes eredetűek. Gombák és baktériumok termelik a más baktériumok elleni folyatott evolúciós küzdelem során. És persze ennek megfelelően, az evolúciós fegyverkezési versenyek logikájából kifolyólag, a rezisztencia is a természetes populációkban jelent meg.
Méghozzá régen. Hogy mennyire régen azt nehéz megmondani, de akár a százmillió éves sacc is megállhatja a helyét.
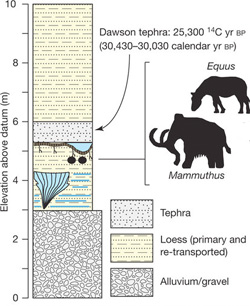
Ha ennyire nem is ástak le mélyre a héten a Nature-ben ismertetett tanulmány szerzői, azért az alaszkai mintavevőhelyükön kb. 30,000 év mélységre leástak. Az innen izolált mintában (ami nyomokban még mamut DNS-t is tartalmazott, eredetiségét bizonyítandó) aztán megvizsgálták, milyen antibiotikusm rezisztencia gének voltak fellelhetőek.
Tetraciklin-, penicillin-, vancomycin-, lincosamide-rezisztencia; ami csak eszükbe jutott, mind jelen volt. Az izolált DNS szakaszok szinte kivétel nélkül beilleszthetőek voltak a mai rezisztencia gének filogenetikai fáiba, sok esetben csak minimális szekvencia és strukturális változás volt tetten érhető. (Mindezek fényében talán még kevésbé meglepő az antibiotikum rezisztencia gének természetes előfordulásának gyakorisága.)
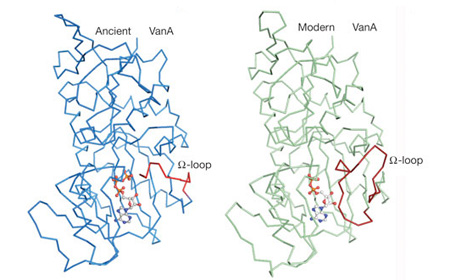 Például a mellékelt ábrán látható vankomicin rezisztencia gén, a VanA fedőnevű enzim szerkezete. Ha az ősi és a modern szekvencia alapján megjósolható három dimenziós szerkezeteket egymás mellé tesszük látható, hogy egyetlen régiója van a fehérjének, ahol számottevőbb változás következett be, mégpedig az úgynevezett “Ω-hurok”, ám ez nem befolyásolja az enzim működését.
Például a mellékelt ábrán látható vankomicin rezisztencia gén, a VanA fedőnevű enzim szerkezete. Ha az ősi és a modern szekvencia alapján megjósolható három dimenziós szerkezeteket egymás mellé tesszük látható, hogy egyetlen régiója van a fehérjének, ahol számottevőbb változás következett be, mégpedig az úgynevezett “Ω-hurok”, ám ez nem befolyásolja az enzim működését.
Mit érdemes ezek alapján észben tartani? Hogy gyógyszereink révén egy ősi evolúciós verseny haszonélvezői vagyunk. Ám mint minden eféle versenyben a totális győzelem elérhetetlen és az előnyök csak időszakosak. Rezisztencia volt és lesz, ám ha ésszel használnánk gyógyszereinket ez lényegesen kevesebb veszélyt jelentene.
D’Costa VM, King CE, Kalan L, Morar M, Sung WW, et al. (2011) Antibiotic resistance is ancient. Nature 477: 457-461.

Ezzel kapcsolatban mindig eszembe jut, hogy az agyonreklámozott Normaflore multirezisztens törzse vajon képes-e átadni ezt a tulajdonságát? Az engedélyezési eljárásban vajon vizsgálták-e, hogy nem válik-e mindenki, aki beszedi, a rezisztenciáért felelős gén átvitelének mini reaktorává? Persze nem néztem utána, hogy ez a gén milyen típusú, és kromoszómán vagy plazmidon található, ettől függetlenül nekem fura, hogy szabadon szedhető egy ilyen készítmény! Ha valaki erről többet tud, szívesen olvasnám!
@Fluoro: A Normaflore csak magyar szovegkornyezetben jelenik meg, de a gyartojanak (Sanofi-Aventis) vagy egy Enterogermina nevu keszitmenye, ami hasonlokeppen bacillus sporak amit tobbszorosen rezisztensek antibiotikumokra.
Lehet, hogy ugyanaz, csak Magyarorszagon valamiert mas neven forgalmazzak?
Errol a keszitmenyrol van szakirodalom.
aem.asm.org/content/65/9/4288.full
Kromoszomalis mutaciok biztositjak a rezisztenciat, ezek sokkal specifikusabbak az adott fajra, es nehezebb az atadasuk mas torzseknek.
A plazmidon kodolt rezisztencia genek (altal kodolt feherjek) rendszerint semlegesitik az antibitikumot, kemiai atalakitassal, vagy azzal, hogy kifele pumpaljak az sejtbol. Ez a mechanizmus konnyen atadhato fajok kozott.
Raadasul a plazmidok egy resze eleverendelkezik olyan mechanizmussal, hogya sejtek at tudjak adni egymasnak.
A kromoszomalis rezisztencia mutaciok altalaban az adott antibiotikum celpontjat (pl RNS polimeraz, riboszoma stb) modositjak, ugy, hogy az antibitikum hatastalan legyen. Mivel az antibitikum celpontja altalaban egy letfontossagu feherje mukodese, ennek az atadasa mas fajnak igen valoszinutlen. Igy en kulonosebben nem aggodnek miatta.
“One strain was isolated by single- and multistep selection methods, which conferred chromosomal-borne resistance to erythromycin, lincomycin, cephalosporins, and cycloserine (5). Further derivatives, resistant to chloramphenicol (derivative O/C), novobiocin and rifampin (derivative N/R), tetracycline (derivative T), and streptomycin and neomycin (derivative SIN) were subsequently isolated from this strain.”