Manapság Richard Lenski kísérlete kapja a legtöbb figyelmet, de azért már sokkal korábban is végeztek in vitro evolúciós vizsgálatokat. Ma egy ilyen többé-kevésbé elfelejtett munkát szeretnék bemutatni, még a hetvenes-nyolcvanas évekből.
Az E. coli baktérium Lac-operonja a génszabályozás tankönyvi példája. Ennek köszönhetően a baktérium képes laktózt, azaz tejcukrot is felhasználni, ehhez azonban két fehérjére is szüksége van: Mivel a sejt nem képes közvetlenül felhasználni a tejcukrot kell egy β-galaktozidáz nevű enzim, ami egy galaktózra és egy glükózra hasítja a tejcukrot, amelyeket már felhasználhat a sejt. Ezen kívül szükséges még egy laktóz-permeáz nevű fehérje, ami a külvilágból a sejtbe juttatja a tejcukrot. A Lac-operon ezen kívül tartalmaz még egy laktóz transzacetiláz nevű fehérjét kódoló gént is, ez a fehérje egy acetilcsoportot illeszt a tejcukorhoz, ám ez a tejcukor felhasználásához nem elengedhetetlenül szükséges. Ezt a három fehérjét kódoló lacZ, lacY és lacA gén a genomban egymás közvetlen közelében helyezkedik el, egy közös promótert használnak, egy közös messenger RNS képződik róluk, amiről aztán a három különböző fehérje íródik át.
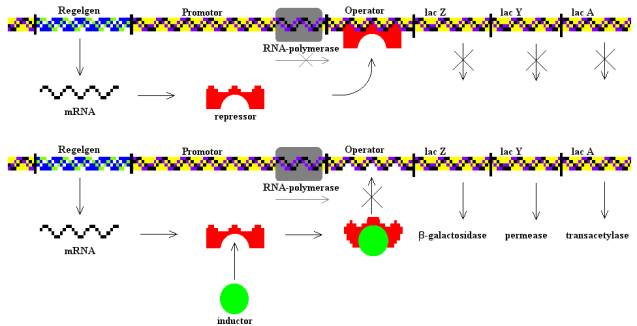
Mivel a három fehérjét megtermelni jelentős energiabefektetés a sejtnek, kézenfekvő, hogy csak akkor fordít erre az erőforrásaiból, ha a táptalajban van egyáltalán tejcukor, hiszen ha a környezetében mondjuk csak szőlőcukrot talál, teljesen fölösleges pazarlás megszintetizálni a három enzimet. Éppen ezért a promóter és a három struktúrgén között egy operátornak nevezett DNS szekvencia található a genomban. Ennek egyetlen szerepe, hogy ezt a DNS szekvenciát felismeri egy Lac represszornak nevezett fehérje, amely képes ehhez a pontosan meghatározott bázissorrendű DNS szakaszhoz kötődni. Ha pedig hozzákötött, akkor meggátolja, hogy az RNS polimeráz a promóterhez kötődjön, így a struktúrgének sem íródnak át, a sejt nem termeli meg a három enzimet. Azonban ez a represszor fehérje nem csak az operátor DNS szekvenciához képes kötni, hanem a tejcukor bontásegyik köztitermékéhez is, az allolaktózhoz, márpedig, ha allolaktózhoz kötődik, megváltozik a térszerkezete és nem képes tovább kötődni az operátor DNS szekvenciához. Ezáltal az RNS polimeráz enzim hozzáfér a Lac-operon promóteréhez, átírja messenger RNS -sé a három gént, amiről aztán fehérje képződik.
Magyarul, ha a sejtben nincs tejcukor, a represszor fehérje szorosan kötődik az operátor DNS szakaszhoz és megakadályozza, hogy a sejt megszintetizálja a három enzimet, ellenben ha tejcukor is található a sejtben, az inhibítorfehérje leválik az operátorról, átíródik a három gén, a sejtben megjelenik a három fehérje.
Ezzel a meglehetősen jól ismert szabályozórendszerrel végeztek kísérleteket John H. Campbell és munkatársai 1973 -ban. A rendszerük pofonegyszerű volt: Fogtak egy mutáns E. coli törzset, amelyben egy deléció eltávolította a lacZ gént, ami így nem termelhetett β-galaktozidáz enzimet, képtelen volt a tejcukrot szőlőcukorra és galaktózra hasítani. Ezt a baktériumtörzset tetrazólium-laktóz indikátorral kiegészített agarlemezekre szélesztették. Ezen a táptalajon a tejcukrot felhasználni képtelen baktériumtörzs is nő, ám ezek a telepek vörös színűek. Azonban ha tejcukrot felhasználni képes, β-galaktozidáz enzimet termelő sejteket szélesztenek a lemezekre, azok fehér színű telepeket alkotnak.
Szóval lacZ deléciós mutáns törzset szélesztettek erre az indikátorral kiegészített agarlemezre, majd 37 Celsius-fokon növesztették őket két napon át. Ezek után szobahőn hagyták a lemezeket nyolc héten át. (A közleményben nem írják, de fogadni mernék, hogy elfelejtették kidobni a használt lemezeket.) Ekkor észrevették, hogy a nagy, piros telepeken itt-ott apró, fehér telepek jelentek meg, amik látszólag képessé váltak a tejcukor felhasználására. Fogták az egyik ilyen fehér telepet és szénforrásként kizárólag tejcukrot tartalmazó minimáltáptalajra kenték, ahol nagyon lassan, de telepeket képeztek ezek a baktériumsejtek, egyértelműen mutatva, hogy alacsony hatékonysággal, de képesek felhasználni a tejcukrot is. Ezek lettek az Ebg-1 sejtek (Evolved beta-galactosidase-1). Ezt a lemezt öt napon át inkubálva, a lassan növő telepekben gyorsabban növő fióktelepeket vettek észre, ezek közül a legnagyobbat friss táptalajra oltották, őbelőle lettek az Ebg-2 sejtek. Ezek között is megjelentek idővel gyorsabban növő mutánsok, Őket is újra oltották, ők lettek az Ebg-3 sejtek és így folytatták egészen Ebg-5 -ig, amely baktériumok már a vad típusú E. coli-val azonos gyorsasággal nőttek kizárólag tejcukrot mint szénforrást tartalmazó minimáltáptalajon, vagyis legalább olyan jól hasznosították a tejcukrot, mint a vad törzs. Érdekesmód, ezek az Ebg-5 sejtek az indikátorral kiegészített táptalajon rózsaszín telepeket képeznek, világosabbakat, mint a szülői törzs, de egyértelműen sötétebbeket, mint a vad törzs. Ha biokémiai módszerekkel összehasonlították az Ebg-5 törzs tejcukorbontó aktivitásáért felelős fehérjét a vad típusú β-galaktozidáz enzimmel, azt találták, hogy jelentősen különbözik tőle. A β-galaktozidáz enzim a működéséhez nátriumionokat igényel, az Ebg káliumot, a nátrium éppen gátolja a működését. Ezen kívül aktivitásában, molekulatömegében, pH optimumában különbözik tőle, ráadásul még a β-galaktozidáz fehérjét felismerő ellenanyagokkal sem mutatható ki. Ráadásul ezek a mutációk nem a Lac-operon területére térképeződtek, az EBG-5 jelleg kialakításáért felelős változások a kromoszóma egészen más pontján történtek, tehát nem arról van szó, hogy helyreállt volna valahogyan a vad β-galaktozidáz fehérje, hanem itt bizony egy teljesen új enzim alakult ki.
A munkát Barry G. Hall és Daniel L. Hartl folytatta a hetvenes években, akik gyakorlatilag előről kezdtek mindent, mivel Campbellék nem őrizték meg az Ebg-1 – Ebg-4 törzseket, csak az Ebg-5 baktériumtörzset tartották meg, így Hallék újra elvégezték a kísérletet, így harmincnégy független tejcukrot emésztő lacZ deléciós törzset állítottak elő, ezzel bemutatva, hogy nem valamiféle kozmikus szerencsének köszönhető az első eset. Ezek közül három törzs az eredeti Ebg-5 höz hasonlóan a vad típusúval azonos sebességgel nőtt tejcukrot tartalmazó minimáltáptalajon, ezek állandóan, nagy mennyiségbentermelték a tejcukor emésztéséhez szükséges enzimet, míg harmincegy törzs egyharmad sebességgel nőtt tejcukron, ám ezek csak akkor termelték a tejcukorbontó enzimet, ha a táptalaj tartalmazott is tejcukrot, azaz őbennük ez ugyanúgy indukálható, mint a vad törzsben a β-galaktozidáz termelése. Mind a harmincnégy törzs Ebg enzime ugyanúgy viselkedett biokémiai vizsgálatokban, mint az eredeti Ebg-5 enzim, ráadásul mindet felismerte az Ebg-5 -öt felismerő ellenanyag
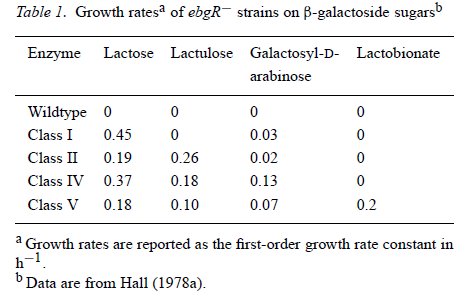 Ebből viszont nyilvánvalóvá vált, hogy minden törzsben ugyanannak a génnek a mutációi alakították ki a tejcukrot hasítani képes Ebg enzimet. Mi is ez az eredeti Ebg fehérje? Hogy megvizsgálják a működését, négy különböző cukor felhasználását vizsgálták. A tejcukrot már ismerjük, a laktulóz (galaktozil-β-D-fruktóz) és a galaktozil-β-D-arabinóz a természetben nem fordul elő, a laktobionát pedig nagyon ritkán. E négy cukor felhasználásával az Ebg enzimek biokémiai jellemzése is elvégezhető. A vad Ebg egyiket sem képes hasítani, az ezt hordozó baktériumsejtek nem nőnek olyan minimáltáptalajon, amely csak ezeket tartalmazza szénforrásként. A különböző, tejcukrot hasítani képes enzimek viszont négy csoportra oszthatóak, ezek láthatóak a táblázaton.
Ebből viszont nyilvánvalóvá vált, hogy minden törzsben ugyanannak a génnek a mutációi alakították ki a tejcukrot hasítani képes Ebg enzimet. Mi is ez az eredeti Ebg fehérje? Hogy megvizsgálják a működését, négy különböző cukor felhasználását vizsgálták. A tejcukrot már ismerjük, a laktulóz (galaktozil-β-D-fruktóz) és a galaktozil-β-D-arabinóz a természetben nem fordul elő, a laktobionát pedig nagyon ritkán. E négy cukor felhasználásával az Ebg enzimek biokémiai jellemzése is elvégezhető. A vad Ebg egyiket sem képes hasítani, az ezt hordozó baktériumsejtek nem nőnek olyan minimáltáptalajon, amely csak ezeket tartalmazza szénforrásként. A különböző, tejcukrot hasítani képes enzimek viszont négy csoportra oszthatóak, ezek láthatóak a táblázaton.
Az első csoportba Campbell Ebg-5 enzimje tartozik és az első kísérlet három tejcukrot jól hasznosító enzimje. Az ezeket hordozó sejtek gyorsan nőnek tejcukron, nagyon lassan laktulózon (24 óránként osztódnak), a többi két cukron pedig éhen halnak. Egy újabb kísérletben azonban találtak olyan törzseket is, amelyek fele olyan gyorsan nőttek tejcukron, mint az Ebg-5 törzs, ezek Ebg enzimjei alkotják a második csoportot, amelyek képesek laktulózon is nőni. Ezek után kipróbálták, hogy ha az I. csoport sejtjeit laktulózon növesztik, kialakulnak -e belőlük laktulózt is felhasználni képes sejtek. Kialakultak, azonban ezen Ebg enzimek különböztek a II. csoport enzimjeitől, gyorsabban osztódtak tejcukron és galaktozil-β-D-arabinózon, ők lettek a IV. csoport. Ezek közül azonban egyik törzs sem hasznosított laktobionátot, sőt, az I. és a II. csoportból nem is sikerült ilyen mutánsokat létrehozni, pedig többször is próbálkoztak vele. Ellenben a IV. csoport sejtjeiből könnyedén létrejöttek laktobionátot is felhasználó mutánsok, az E. coli sejtek a legkülönbözőbb cukrok felhasználásra váltak képessé.
Itt egészen új irányt vettek a kísérletek. Ugye a represszorfehérjét szabályozó allolaktóz a tejcukorbontás egyik közti terméke, amit éppen a β-galaktozidáz enzim termel. Mivel ahhoz, hogy a tejcukor bejusson a sejtbe, szükséges a laktóz-permeáz fehérje is, ami csak akkor termelődik, ha a sejtben allolaktóz is található, a lacZ deléciós mutánsok (az összes eddig vizsgált törzs) nem termelnek laktóz-permeázt sem, így nem is képesek fölvenni a táptalajból a tejcukrot. A kísérletek során ezért IPTG -t adtak a táptalajhoz, ami ugyanúgy kötődik a represszorfehérjéhez, mint az allolaktóz, ám a sejt nem képes energiaforrásként hasznosítani, így a kísérleteket nem zavarja. Az eddig tárgyalt Ebg enzimeknek ugyanis van egy nagyon lényeges közös tulajdonsága: A tejcukor bontása során egyikük sem termel allolaktózt, így nem képesek a laktóz-permeáz termelődését sem indukálni. A IV. csoportba tartozó enzimek azonban allolaktózt is termelnek, IPTG hiányában is képesek indukálni a laktóz-permeáz enzim szintézisét, így vígan elvannak tejcukron, segédanyagok nélkül is.
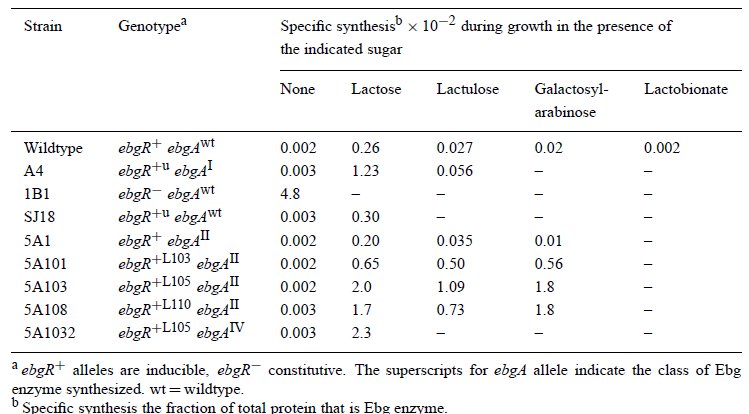 No most ahogy az előbb írtam, a mutánsok egy része indukálható volt, vagyis csak tejcukor jelenlétében termelt Ebg enzimet. Azt megállapították, hogy a tejcukor jó indukálószer, az alap génaktivitást százszorosára növeli. Ez az érték azonban még mindig csak huszada volt a konstitutív expressziós szintnek, ezért nőttek az indukálható mutánsok lassabban tejcukron. Egy II. csoportba tartozó, indukálható mutációból kiindulva megvizsgálták, hogy keletkeznek -e olyan mutánsok, amelyek nem csak laktózzal, hanem a többi cukorral is indukálhatóak? Természetesen találtak ilyeneket is, ebben a táblázatban láthatóak a jellemzőbb tulajdonságaik, a vad típusúhoz képest mindenféle más indukálószert előnyben részesítő mutánsok is akadnak.
No most ahogy az előbb írtam, a mutánsok egy része indukálható volt, vagyis csak tejcukor jelenlétében termelt Ebg enzimet. Azt megállapították, hogy a tejcukor jó indukálószer, az alap génaktivitást százszorosára növeli. Ez az érték azonban még mindig csak huszada volt a konstitutív expressziós szintnek, ezért nőttek az indukálható mutánsok lassabban tejcukron. Egy II. csoportba tartozó, indukálható mutációból kiindulva megvizsgálták, hogy keletkeznek -e olyan mutánsok, amelyek nem csak laktózzal, hanem a többi cukorral is indukálhatóak? Természetesen találtak ilyeneket is, ebben a táblázatban láthatóak a jellemzőbb tulajdonságaik, a vad típusúhoz képest mindenféle más indukálószert előnyben részesítő mutánsok is akadnak.
Ezen a ponton viszont már fel tudták rajzolni, hogyan alakulhat ki egy új szénforrást hasznosító enzim. Az első mutáció egy II. típusú Ebg enzimet eredményez, az ezt hordozó sejtek még képtelenek tisztán tejcukron elélni, de az indikátorlemezen már jelentősen megnő az életképességük, látható dudorokat képeznek a telepeken belül. Ebben a törzsben történt egy mutáció az Ebg operon represszorfehérjéjében, aminek eredményeként már a tejcukor is eléggé indukálta az enzim termelését ahhoz, hogy tisztán tejcukron is eléljen a sejt. Ezek után egy harmadik mutáció történt az Ebg enzimet kódoló génben, ami IV. típusú Ebg enzimmé alakította, így a sejt már képessé vált a tejcukor emésztésére, miközben allolaktózt is felszabadított, így képessé vált a laktóz-permeáz enzim indukálható termelésére is. Három pontmutációval a sejt máris teljes mértékben pótolni tudja a kieső β-galaktozidáz enzimet, ráadásul az új operon szabályozása is megoldott ugyanezzel a három mutációval.
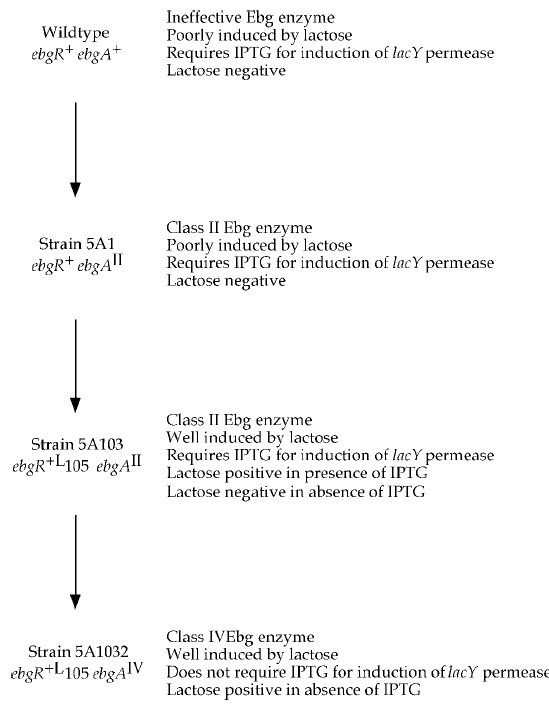
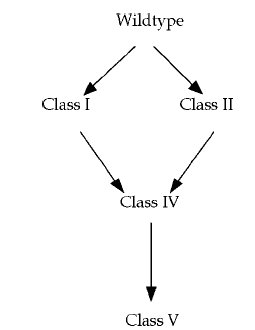 Időközben a nyolcvanas években lehetővé vált a DNS közvetlen szekvenálása, így kiderülhetett, hogy milyen mutációk is felelősek valójában ezen jellegek kialakulásáért. Az I. csoport Ebg enzim létrejöttéhez elég egyetlen pontmutáció, ahogy a II. csoportba tartozó Ebg enzimek is egyetlen pontmutáció termékei. A IV. csoportba tartozó enzimek egyszerűen az I. csoportra jellemző és a II. csoportra jellemző mindkét pontmutációt hordozzák. Az V. csoportba tartozó enzimek egy újabb pontmutációt hordoznak. A represszorfehérjében öt különböző pontmutáció bármelyike a leírt fenotípust eredményezi.
Időközben a nyolcvanas években lehetővé vált a DNS közvetlen szekvenálása, így kiderülhetett, hogy milyen mutációk is felelősek valójában ezen jellegek kialakulásáért. Az I. csoport Ebg enzim létrejöttéhez elég egyetlen pontmutáció, ahogy a II. csoportba tartozó Ebg enzimek is egyetlen pontmutáció termékei. A IV. csoportba tartozó enzimek egyszerűen az I. csoportra jellemző és a II. csoportra jellemző mindkét pontmutációt hordozzák. Az V. csoportba tartozó enzimek egy újabb pontmutációt hordoznak. A represszorfehérjében öt különböző pontmutáció bármelyike a leírt fenotípust eredményezi.
Megvizsgálták, hogy más mutációk is létrehozhatták -e ugyanezeket az enzimeket és meglepő módon azt találták, hogy nem, minden egyes esetben ugyanaz a pontmutáció eredményezte az I. II. és az V. típusú enzimek megjelenését. A represszorfehérje esetében nem ez a helyzet öt mutáció bármelyike megtörténhet benne. A másik érdekes kérdés, hogy az Ebg fehérjén kívül van -e még olyan a genomban, amelyik mutációk hatására képessé válhat tejcukor hasítására? Ugyanezzel a módszerrel megpróbáltak lacZ és ebgA deléciós mutánsokból tejcukrot felhasználni képes baktériumokat nyerni, ám ilyenek nem alakultak ki, úgy tűnik a K12 E. coli genomjában ez az egyetlen fehérje, amely néhány pontmutációval képessé válhat tejcukor hasítására. Adja magát a kérdés, hogy akkor mit is csinál az Ebg fehérje a sejtben? Ezt a mai napig senki sem tudja, ha deletálják a gént, semmi sem történik, a baktérium él tovább, mint azelőtt, de ez semmit sem mond arról, hogy a természetben mi lehet a szerepe.
Ez a kísérletsorozat betekintést nyújt az új biokémiai útvonalak kialakulásába. Engem nagyon meglepett, hogy egy meglévő operon átállítása egy másik szubsztrátra ilyen könnyen megy, valahogyan mindig úgy gondoltam, hogy ehhez millió évek kellenek, nem néhány hét egy agarlemezen. Az új, természetben ismeretlen cukrok hasznosítása is hihetetlen gyorsan lehetővé vált, ez elég jól mutatja, hogy milyen sebességgel alkalmazkodhatnak az élőlények a környezet változásaihoz.
B. G. Hall (2003):The EBG system of E. coli: origin and evolution of a novel beta-galactosidase for the metabolism of lactose. Genetica 118(2-3):143-56.

Ket aprosag:
” Ez a táptalaj **szőlőcukrot is tartalmaz**, tehát ez a tejcukrot felhasználni képtelen baktériumtörzs is nő rajta, ám ezek a telepek vörös színűek. Azonban ha tejcukrot felhasználni képes, β-galaktozidáz enzimet termelő sejteket szélesztenek a lemezekre, azok fehér színű telepeket alkotnak. ”
Ezt nezd at, azt hiszem, hogy itt valami felreertes van, a tetrazolium a tejcukor vagy szolocukor felhasznalasakor egyforman feher telepeket fog eredmenyezni (a pH ertek valtozasan keresztul hat, ha cukrot eszik a baci, akkor savanyodik a taptaj, es szintelen marad a tartazolium. A lac- sejtek valoszinuleg taptalaj aminosavain eltek, nem masik cukron.
Altalaban gazdag taplajhoz (pl LB) adjuk a tetrazoliumot es a vizsgalt cukrot.
“Az első mutáció egy II. típusú Ebg enzimet eredményez, az ezt hordozó sejtek még képtelenek tisztán tejcukron elélni, de szőlőcukor*** jelenlétében már jelentősen megnő az életképességük, látható dudorokat képeznek a telepeken belül.”
Itt valoszinuleg tejcukrot akartal irni.
Nagyon jo cikk, gratulalok!
@tamaskodo: Köszönöm, javítottam!
Van egy-két dolog, amit nem teljesen értek.
Az Ebg , egy random fehérjéből alakult ki, aminek alapból semmi köze a laktóz bontáshoz? És minden esetben abból a fehérjéből alakult ki?
A másik pedig: az allolaktóz kötődik az inhibitor-fehérje centrumához, így lesz átírás a lac Z,Y,A-ról. De az allolaktóz képzéséhez, kell a béta-galaktozidáz, amihez kell az allolaktóz jelenléte stb. ez nem egy ördögi kör?
Segíts kérlek!
@drhzf:
“Az Ebg , egy random fehérjéből alakult ki, aminek alapból semmi köze a laktóz bontáshoz?”
Igen, a génje ott volt eredetileg is a genomban. Ha eltávolíják, a tejcukor felhasználás semmilyen zavart sem szenved.
“És minden esetben abból a fehérjéből alakult ki?”
Hetedik bekezdés: … Hallék újra elvégezték a kísérletet, így harmincnégy független tejcukrot emésztő lacZ deléciós törzset állítottak elő, ezzel bemutatva, hogy nem valamiféle kozmikus szerencsének köszönhető az első eset. … Mind a harmincnégy törzs Ebg enzime ugyanúgy viselkedett biokémiai vizsgálatokban, mint az eredeti Ebg-5 enzim, ráadásul mindet felismerte az Ebg-5 -öt felismerő ellenanyag.
“De az allolaktóz képzéséhez, kell a béta-galaktozidáz, amihez kell az allolaktóz jelenléte stb. ez nem egy ördögi kör?”
Tizedik bekezdés: Ugye a represszorfehérjét szabályozó allolaktóz a tejcukorbontás egyik közti terméke, amit éppen a β-galaktozidáz enzim termel. Mivel ahhoz, hogy a tejcukor bejusson a sejtbe, szükséges a laktóz-permeáz fehérje is, ami csak akkor termelődik, ha a sejtben allolaktóz is található, a lacZ deléciós mutánsok (az összes eddig vizsgált törzs) nem termelnek laktóz-permeázt sem, így nem is képesek fölvenni a táptalajból a tejcukrot. A kísérletek során ezért IPTG -t adtak a táptalajhoz, ami ugyanúgy kötődik a represszorfehérjéhez, mint az allolaktóz, ám a sejt nem képes energiaforrásként hasznosítani, így a kísérleteket nem zavarja. Az eddig tárgyalt Ebg enzimeknek ugyanis van egy nagyon lényeges közös tulajdonsága: A tejcukor bontása során egyikük sem termel allolaktózt, így nem képesek a laktóz-permeáz termelődését sem indukálni. A IV. csoportba tartozó enzimek azonban allolaktózt is termelnek, IPTG hiányában is képesek indukálni a laktóz-permeáz enzim szintézisét, így vígan elvannak tejcukron, segédanyagok nélkül is.
@drhzf:
“Az Ebg , egy random fehérjéből alakult ki, aminek alapból semmi köze a laktóz bontáshoz?”
Igen, a génje ott volt eredetileg is a genomban. Ha eltávolíják, a tejcukor felhasználás semmilyen zavart sem szenved.
“És minden esetben abból a fehérjéből alakult ki?”
Hetedik bekezdés: … Hallék újra elvégezték a kísérletet, így harmincnégy független tejcukrot emésztő lacZ deléciós törzset állítottak elő, ezzel bemutatva, hogy nem valamiféle kozmikus szerencsének köszönhető az első eset. … Mind a harmincnégy törzs Ebg enzime ugyanúgy viselkedett biokémiai vizsgálatokban, mint az eredeti Ebg-5 enzim, ráadásul mindet felismerte az Ebg-5 -öt felismerő ellenanyag.
“De az allolaktóz képzéséhez, kell a béta-galaktozidáz, amihez kell az allolaktóz jelenléte stb. ez nem egy ördögi kör?”
Tizedik bekezdés: Ugye a represszorfehérjét szabályozó allolaktóz a tejcukorbontás egyik közti terméke, amit éppen a β-galaktozidáz enzim termel. Mivel ahhoz, hogy a tejcukor bejusson a sejtbe, szükséges a laktóz-permeáz fehérje is, ami csak akkor termelődik, ha a sejtben allolaktóz is található, a lacZ deléciós mutánsok (az összes eddig vizsgált törzs) nem termelnek laktóz-permeázt sem, így nem is képesek fölvenni a táptalajból a tejcukrot. A kísérletek során ezért IPTG -t adtak a táptalajhoz, ami ugyanúgy kötődik a represszorfehérjéhez, mint az allolaktóz, ám a sejt nem képes energiaforrásként hasznosítani, így a kísérleteket nem zavarja. Az eddig tárgyalt Ebg enzimeknek ugyanis van egy nagyon lényeges közös tulajdonsága: A tejcukor bontása során egyikük sem termel allolaktózt, így nem képesek a laktóz-permeáz termelődését sem indukálni. A IV. csoportba tartozó enzimek azonban allolaktózt is termelnek, IPTG hiányában is képesek indukálni a laktóz-permeáz enzim szintézisét, így vígan elvannak tejcukron, segédanyagok nélkül is.
Én nem a kísérletben lévő baktériumokra gondoltam, hanem a valódi életben, ahol nincs külső IPTG. Nem értem teljesen, nem a szöveg hibája, hanem az enyém. Tehát allolaktóz kell ahhoz is, hogy a permeáz bejuttassa a sejtbe a laktózt? De hogy képződik az az allolaktóz?
@drhzf:
Így már értem a kérdést. Egyetlen biokémiaia reakció sem száz százalékos hatékonyságű. Az, hogy a lac-operon represszált, nem azt jelenti, hogy egyáltalán nem fejeződik ki, hanem, hogy az idő nagy részében nem íródik át. Ettől bármikor történhet olyan, hogy véletlen elindul a transzkripció indukálószer hiányéban is így lehetséges, hogy a baktériumsejtben található egy-két fehérjemolekula indukció nélkül is. Mivel az egész operon egyszerre íródik át, ha egy sejtben termelődik valamennyi béta-galaktozidáz, akkor termelődik mellé laktóz-permeáz is.
Nyilván ez nem zavarja a jószágot, mert annyira kis mennyiség, de ha tejcukor kerül a táptalajba, akkor az egy-két molekula laktóz permeáz elég hozzá, hogy kis mennyiségű tejcukor bejusson a sejtbe, onnantól pedig néhány molekula béta-galaktozidáz is elég hozzá, hogy nagyon kevés allolaktózt készítsen, ami már valamennyire aktiválja a lac-operont.
A biológiai rendszerek általában zajosak és ez sokszor az előnyükre válik.
Ez marha izgalmas, érdekelne, van-e valami térszerkezeti infó az Ebg fehérjékről (én egyelőre nem találtam), az segíthet annak megfejtésében, miért éppen ezek tudják ilyen jól pótolni a LacZ-t.
Hogy okoskodjak is egy kicsit Sexcomb utolsó hozzászólása kapcsán: a biokémiakönyvek ábrái alapján hajlamosak lehetünk a molekuláris folyamatokat ha -> akkor szabályok szerint mereven működő rendszereknek tekinteni (igen/nem kimenettel), de sokkal közelebb áll a valósághoz, ha a fehérje-fehérje (stb.) kölcsönhatásokat kémiai egyensúlyok sorozataként fogjuk fel, így jobban érthető talán a “zaj”.
“Ez marha izgalmas, érdekelne, van-e valami térszerkezeti infó az Ebg fehérjékről…”
Legjobb tudomásom szerint nincs.
“sokkal közelebb áll a valósághoz, ha a fehérje-fehérje (stb.) kölcsönhatásokat kémiai egyensúlyok sorozataként fogjuk fel, így jobban érthető talán a “zaj”.”
No most a helyzet az, hogy a hétköznapi életben ahhoz vagyunk szokva, hogy a tárgyak maguktól nem kószálnak el. Mondjuk ka egy csavarra rátekered az anyát, akkor rajta marad. Ha letekered róla, akkor már eltávolodik tőle. Azonban abban a mérettartományban, ahol fehérjekomplexekről beszélhetünk, ezek a dolgok egészen másképpen történnek. Egyrészt nem egyetlen molekuláról beszélünk, hanem nagyon sokról (A lac-operon esetében legalább azt tudjuk, hogy egyetlen operátor régió található a kromoszómán.), ráadásul minden egyes résztvevőnek Brown-mozgása is van, tehát folyamatosan lökdösik a vízmolekulák össze-vissza (hu.wikipedia.org/wiki/Brown-mozg%C3%A1s).
Egy ilyen kötés úgymond “lélegzik”, azaz a komplexet alkotó molekulák időnként eltávolodnak egymástól, oda mások is “befurakodhatnak”, a komplexet alkotó molekulák folyton cserélődnek. Az egyik fehérje elhagyja a DNSt, a másik a helyére köt. Éppen ezért, bár azt mondjuk, hogy “köt” vagy “nem köt”, de nem lehet ezt ilyen egyszerűen kijelenteni, a fehérjekomlexeknek disszociációs állandója van, ami azt a ligandkoncentrációt jelenti, ahol a receptor kötőhelyeinek a fele foglalt. (en.wikipedia.org/wiki/Dissociation_constant) Nyilván minél kisebb ez az érték, annál erősebb a ligand és a receptor kölcsönhatása, de attól még sohasem zárható ki, hogy valamennyi időre szabad receptor marad a rendszerben. Éppen ezért lehetséges, hogy valami bazális expressziós szint akkor is marad, ha a represszor “köt” a DNShez, egyszerűen azért, mert ettől rövid időre még nyugodtan szabaddá válhat a DNS. Ez a rendszerben a zaj, ami egyszerűen az elemek mérettartományából következik.