 Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
A múlt héten megjelent Nature cikk alapján ez azonban erősen kétségesnek tűnik.
A szóban forgó kísérlet elsőre zseniálisan egyszerű: egy baktériumtenyészetet egyre növekvő antibiotikum koncentrációjú közegben kezdtek el nevelni és figyelték, hogy miként változik a teljes szuszpenzió rezisztenciája.
A felhasznált norfloxacint úgy adagolták egy bioreaktorba, hogy kb. 40%-át tegye lehetővé normális növekedési potenciálnak. Ezt az értéket (minimum inhibitory concentration – MIC) minden nap újra meghatároztak, és amikor a rezisztencia növekedni kezdett, emelték az antibiotikum koncentrációt is.
A klasszikus elmélet az mondaná, hogy a teljes bakteriális populáció rezisztenciájában való növekedést az okozza, hogy egy-egy egyedben kialakul a rezisztencia, majd ennek az egyednek az utódjai nagyon gyorsan elterjednek és a növekedési potenciál változása ennek a folyamatnak köszönhető. És ha egyből nagy antibiotikum koncentrációval ütnénk a bacikat valószínűleg ez is történne. Ellenben a fokozatosság mellett valami mást lehetett megfigyelni.
 Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
Az altruizmus, vagyis a másokon való, személyes hasznot nem hajtó segítés, tipikusan olyan tulajdonságnak tűnhet, amihez minimum komplex idegrendszerre, vagy akár valamilyen morál-tudatra van szükség.
A múlt héten megjelent Nature cikk alapján ez azonban erősen kétségesnek tűnik.
A szóban forgó kísérlet elsőre zseniálisan egyszerű: egy baktériumtenyészetet egyre növekvő antibiotikum koncentrációjú közegben kezdtek el nevelni és figyelték, hogy miként változik a teljes szuszpenzió rezisztenciája.
A felhasznált norfloxacint úgy adagolták egy bioreaktorba, hogy kb. 40%-át tegye lehetővé normális növekedési potenciálnak. Ezt az értéket (minimum inhibitory concentration – MIC) minden nap újra meghatároztak, és amikor a rezisztencia növekedni kezdett, emelték az antibiotikum koncentrációt is.
A klasszikus elmélet az mondaná, hogy a teljes bakteriális populáció rezisztenciájában való növekedést az okozza, hogy egy-egy egyedben kialakul a rezisztencia, majd ennek az egyednek az utódjai nagyon gyorsan elterjednek és a növekedési potenciál változása ennek a folyamatnak köszönhető. És ha egyből nagy antibiotikum koncentrációval ütnénk a bacikat valószínűleg ez is történne. Ellenben a fokozatosság mellett valami mást lehetett megfigyelni.
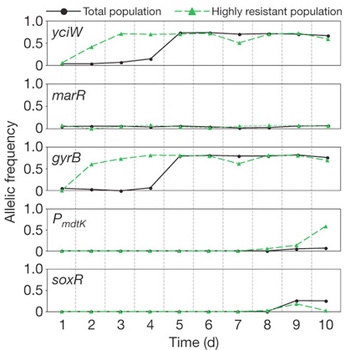
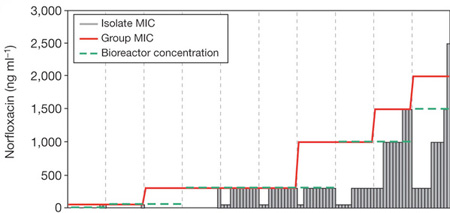 Ha tizenkét izolátumot vettek ki a teljes szuszpenzióból, akkor arra lehetett rácsodálkozni, hogy azok elsöprő többségének lényegesen alacsonyabb volt az antibiotikum toleranciája, mint a teljes tenyészeté, illetve időnként volt egy-egy izolátum, ami meg az átlagosnál magasabb toleranciát mutatott. Ez pedig azt sugallta, hogy a teljes közösség mindössze néhány egyede szedett össze rezisztenciát okozó mutációt, a többieknek valahogy ezek segítenek túlélni.
Ha tizenkét izolátumot vettek ki a teljes szuszpenzióból, akkor arra lehetett rácsodálkozni, hogy azok elsöprő többségének lényegesen alacsonyabb volt az antibiotikum toleranciája, mint a teljes tenyészeté, illetve időnként volt egy-egy izolátum, ami meg az átlagosnál magasabb toleranciát mutatott. Ez pedig azt sugallta, hogy a teljes közösség mindössze néhány egyede szedett össze rezisztenciát okozó mutációt, a többieknek valahogy ezek segítenek túlélni.
De hogyan? A legkézenfekvőbb megoldás, hogy valami olyan fehérjét szekretálnak, ami a többiek esetében is megnöveli a túlélés esélyét. Némi vizsgálódás után kiderült, hogy valóban akad egy ilyen fehérje, a triptofanáz enzimet kódoló (TnA). A TnA szerepe, hogy a triptofánt ammóniává, piruváttá és indollá alakítsa. Mivel az indol szerepe az E. coli stressz-toleranciájában már korábban is felmerült, ez különösen szembetűnő volt.
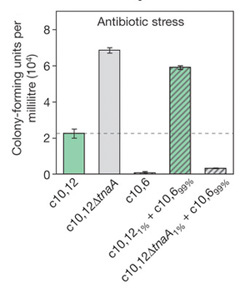 Hogy ellenőrizzék, valóban ilyesmiről van-e szó, egy magas rezisztenciát mutató izolátumból (c10,12) kiütötték az enzimet kódoló tnA gént, majd 1%-99% arányban vegyítették egy rezisztenciát nem hordozó izolátummal (c10,6). A mixet olyan antibiotikum koncentráció mellett próbálták nevelni, amit az utóbbi már nem tolerált.
Hogy ellenőrizzék, valóban ilyesmiről van-e szó, egy magas rezisztenciát mutató izolátumból (c10,12) kiütötték az enzimet kódoló tnA gént, majd 1%-99% arányban vegyítették egy rezisztenciát nem hordozó izolátummal (c10,6). A mixet olyan antibiotikum koncentráció mellett próbálták nevelni, amit az utóbbi már nem tolerált.
Az eredmény elég meggyőző: ha a sejtek kis százaléka képes TnA-t termelni, az a többiek fennmaradását segíti, míg ha nem képes, akkor hiába hordozzák a rezisztenciát a többieken ez nem segít.
A megfigyelés egy másik érdekessége, hogy a deléciót hordozó rezisztens populáció jóval jobban tudott növekedni, mint a rezisztenciát hordozó, de TnA-t is termelő baktériumok, vagyis az enzim termelése jól mérhető fitnesz-csökkenést okozott.
Vagyis az egyszeri megfigyelő mikrobiális altruizmusnak lehet a tanúja. Az antibiotikum-kezelés normális esetben a sejtek halálát okozná, de ha néhány egyedben kialakul a rezisztencia, ezek saját energiájuk egy részét TnA szekretálásra fordítják (egyébként ezt alapfelállásban minden sejt megteszi). Az enzim indolt hoz létre a tápoldatban, az indol pedig bejutva a nemrezisztens társakba olyan mikrobiálisolekuláris pumpák számát fogja fokozni (pl. MdtE), amelyek válogatás nélkül mindenféle idegen anyagot kinyomnak a sejtből, ezzel csökkentve a toxikus antibiotikum koncentrációt.
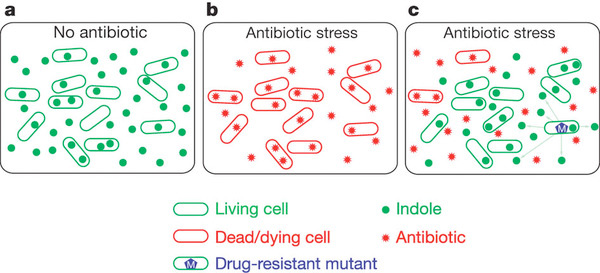
A rendszer látszólag ellentmond a rideg, evolúciós józan észnek, hiszen a rezisztens baktériumnak illetve utódainak kompetitív előnye van a többiekhez képest, így ezt megragadva gyorsan ki kellene szorítaniuk azokat. Hogy az “altruizmusnak” mi lehet mégis az értelme, arra két hipotézist állíthatunk fel és mindkettőhöz jó észben tartani, hogy a nem-rezisztens társak is közeli rokonai a rezisztens izolátumokban fellelhető baktériumoknak, így előbbiek fennmaradása egy szinte tökéletesen megegyező genetikai anyag fennmaradását is jelenti egyben. Az egyik elgondolás szerint, a nagyobb életben maradó populációban nagyobb eséllyel jelennek meg újabb, esetleg még kedvezőbb rezisztencia-mutációk, ha arra jut elég idő. A másik felvetéshez pedig azt kell észben tartani, hogy a rezisztenciának általában fitnesz-ára van. Azért nem rezisztens csuklóból minden baktérium minden antibiotikumra, mert a rezisztenciát kiváltó mutáció antibiotikum-mentes körülmények közt hátrányt jelent. Így, ha a stressz csak átmeneti, a nem rezisztens egyedek túlélése azt jelentheti, hogy a populáció hamarabb vissza tud állni a régi kerékvágásba, a veszély elmúltával.
 Persze, ha az antibiotikum csak nem akar eltűnni a közegből, akkor végül az mégis csak a rezisztencia-allél térnyeréséhez vezet, hiszen az ezt hordozó baktériumok összességében valamivel csak sikeresebbek.
Persze, ha az antibiotikum csak nem akar eltűnni a közegből, akkor végül az mégis csak a rezisztencia-allél térnyeréséhez vezet, hiszen az ezt hordozó baktériumok összességében valamivel csak sikeresebbek.
De ha a kísérlet során megjelenő különböző rezisztencia-mutációk allélgyakoriságát figyeljük, szembetűnik, hogy ez az érték (az adott körülmények között) szinte sosem lesz 1 – vagyis nem fogja a kultúra minden egyede hordozni -, esetenként pedig kifejezetten alacsony marad.
(A félreértések végett érdemes megjegyezni, hogy a rezisztencia-mutációk nem kacsolódnak a TnA-indol rendszerhez, hanem a norfloxacin által megcélzott fehérjéket kódoló génekben jelentek meg.)
(A baktériumos rajz innen származik.)
Lee HH, Molla MN, Cantor CR, Collins JJ (2010) Bacterial charity work leads to population-wide resistance. Nature 467: 82-85.

a visszaellenörzést nem értem. A rezsztens mutáció nem a TnA-hoz kapcsolódik, addig oké, de egyáltalán minek termelődik?
Biztos h ha megnézték h antibiotikumos környezetben a deléciós változat jobban szaporodott a TnA-t termelőnél, akkor ezzel minden saját előnyt biztosító lehetséges okot kizártak?
Hát az értelmezésbe elég nagy hibák csúsztak itt (gondolom, az eredeti szerzők követték el őket). A következőkre gondolok: “a nagyobb életben maradó populációban nagyobb eséllyel jelennek meg újabb, esetleg még kedvezőbb rezisztencia-mutációk” és “ha a stressz csak átmeneti…” Ilyen típusú előrelátás valóban csak magasabbrendű, szinte emberi idegrendszerrel rendelkező élőlényeknél fordulhat elő.
Mivel a Tna termelése költségekkel jár, ezért nekem inkább úgy tűnik, hogy egy egyensúlyi folyamatról van szó. Adott egy gén, a Tna, ami elkezd terjedni a populációban, mert előnyt biztosít az azt hordozó szervezet számára (40%-nál nagyobb túlélés). Mivel ez egy zárt rendszer, véges térfogattal, a fehérje elkezd felhalmozódni, és egy idő után segít a többieknek is. Ha a populáció 10%-a hordozza a gént, akkor annyi Tna lesz az oldatban, hogy ugyanannyira éri meg hordozni a gént, mint nem hordozni. Ha a nem hordozók felé mozdul el a populáció, akkor a hordozás előnyössé válik, és visszabillen. Valamint vice versa. Úgyhogy szerintem ez egy stabil egyensúly, és nem altruizmus.
Biztos lehet olyan okot találni, ami itt nincs megemlítve, de az adott körülmények között a TnA termelése semmilyen külön előnyt nem hozott a baciknak.
@Kupac:
A kritizált rész az pont nincs a cikkben, az az én értelmezésem ;-). Egyébként nem feltételez semmilyen intelligenciát: egyszerűen, ha a feltételezett stressz-szcenárió relatíve gyakori a baktérium természetes élőhelyén, akkor megéri a populáció egészének ilyesmiben gondolkodni (és még mindig nem léptünk túl “az önző gén” logikáján), tehát lesz szelekció efajta kompenzációs mechanizmusokra.
Nem világos, hogy a TnA biztosít valamilyen előnyt a rezisztens baciknak. Nem írtam bele, de ha a TnA-t termelő és attól mentes c(10,12) törzseket együtt neveljük (antibiotikum mellett), a TnA-t termelő simán lenyomja a másikat:
“Of note, c10,12ΔtnaA outgrew c10,12 in isolation. Similarly, in a competitive fitness assay16 where the proportion of the two isolates was initially balanced, c10,12ΔtnaA outcompeted c10,12, leading to a relative fraction of 2.6:1 (c10,12ΔtnaA:c10,12), demonstrating that indole production by HRIs under antibiotic stress carries a fitness cost.”
Izé, a _nem_ termelő nyomja le a másikat, csak a szerkesztő nem engedi javítani.
Jól értem, hogy itt valaki azt állítja, hogy a bacik a saját rovásukra testvéri szeretetből termelik a Tna-t?
Nem, épp ezért írtam bele, hogy milyen evolúciós megfontolások miatt lehet előnyös a mikrobiális “altruizmus”.
Nagyon jo cikk, koszi!
Nekem van egy elvi probleman a jelenseg ertelmezesevel: a termeszetben nagyon ritka az ilyen tiszta tenyeszet, amiben csak egy bakterium utodai szporodnak, sokkla gyakoribbak a vegyes eletkozossegek, ahol sokfajta bakterium el egyutt.
Abban az esetben az nem igaz az, hogy “a nem-rezisztens társak is közeli rokonai a rezisztens izolátumokban fellelhető baktériumoknak, így előbbiek fennmaradása egy szinte tökéletesen megegyező genetikai anyag fennmaradását is jelenti egyben”, hanem barmelyik kornyeken elo bakteriumnak egyforman segit.
Na, elolvastam az eredetit, hogy ne csak a levegőbe beszéljek. Nagyon jó a cucc. Egy dolgot nem találtam benne: vajon a c(10,12) sejteknek is előnyös volt-e a c(10,6) sejtek jelenléte, amikor együtt tenyésztették őket. A grafikonokon csak ez együttes egyedszámot tüntetik fel, nem látom, hogy a kiindulási 1%-hoz képest merre mozdult el a c(10,12). Mert ők is gyorsabban szaporodtak, mint egymagukban, akkor lehet, hogy inkább mutualizmus ez, mint altruizmus.
Bevallom, nekem még mindig nem tetszik a jövőbe tekintő magyarázat, de még rágódok rajta egy kicsit 🙂
Nem értem.
“Vagyis az egyszeri megfigyelő mikrobiális altruizmusnak lehet a tanúja. Az antibiotikum-kezelés normális esetben a sejtek halálát okozná, de ha néhány egyedben kialakul a rezisztencia, ezek saját energiájuk egy részét TnA szekretálásra fordítják (egyébként ezt alapfelállásban minden sejt megteszi). Az enzim indolt hoz létre a tápoldatban, az indol pedig bejutva a nemrezisztens társakba olyan mikrobiálisolekuláris pumpák számát fogja fokozni (pl. MdtE), amelyek válogatás nélkül mindenféle idegen anyagot kinyomnak a sejtből, ezzel csökkentve a toxikus antibiotikum koncentrációt.”
Itt azt írod, hogy alapesetben minden sejt termeli a tna-t (jelentsen ez bármit is 🙂 ÉS a tna termelés segít a kedvezőtlen környezet elviselésében. És azok az egyedek ahol kialakult a rezisztencia (a TNA termeléstől függetlenül) szintén termelik a tna-t és ezzel segítik a nem rezisztenseket is. Hol itt az alturizmus. Szerintem ha eleget vársz akkor létrejön egy tna-t nem termelő verziójú de rezisztens populáció és kiszorít mindenkit. Vagy félreértek valamit?
“Hogy az “altruizmusnak” mi lehet mégis az értelme, arra két hipotézist állíthatunk fel és mindkettőhöz jó észben tartani, hogy a nem-rezisztens társak is közeli rokonai a rezisztens izolátumokban fellelhető baktériumoknak, így előbbiek fennmaradása egy szinte tökéletesen megegyező genetikai anyag fennmaradását is jelenti egyben. Az egyik elgondolás szerint, a nagyobb életben maradó populációban nagyobb eséllyel jelennek meg újabb, esetleg még kedvezőbb rezisztencia-mutációk, ha arra jut elég idő.”
De erről honnan kellene tudni a génkészletnek? A replikátor ebben a rendszerben a gén. Vagyis gén szinten kell előnyt jelentsen egy mutáció ahhoz, hogy elterjedjen. Hacsak nincs egy tervező aki átgondolja ezt a dolgot ugye 🙂
“A másik felvetéshez pedig azt kell észben tartani, hogy a rezisztenciának általában fitnesz-ára van. Azért nem rezisztens csuklóból minden baktérium minden antibiotikumra, mert a rezisztenciát kiváltó mutáció antibiotikum-mentes körülmények közt hátrányt jelent. Így, ha a stressz csak átmeneti, a nem rezisztens egyedek túlélése azt jelentheti, hogy a populáció hamarabb vissza tud állni a régi kerékvágásba, a veszély elmúltával.”
Ez megint igaz de megint nem látom a kapcsolatot az egyes gének fennmaradásával.
Vagy félreértek valamit?
Én egyik magyaráztaban se
@fuhur: A sejtek nem csak akkor kezdik el termelni a TnA-t, amikor stressz éri őket (vagyis nem egy stresszfehérje, ami kisegít), hanem folyamatosan termelik, olyankor is, amikor nem érzékelnek stresszt – lásd egy antibiotikum rezisztens sejt, antibiotikumos közegben. Pedig alapesetben nincs rá szükségük, sőt, ha nem termelik, akkor jobban tudnak szaporodni. És a TnA mégis van, azaz megmaradására szelekció hat. Vagyis úgy tűnik, hogy itt a közösség szempontjából jelentkezik evolúciós előny, nem az egyedéből.
A gén vs génkészlet esetében a klasszikus Dawkinsokban van a válasz, a génnek a legelőnyösebb, ha a már bizonyított környezetében marad fenn, azaz a génkészlet szintűvé válhat a szelekció (remélem tizenplusz év távlatából még jól emlékszem, mit írt az öreg).
Ha jól érzem Te is meg Kupac is félreértitek, hogy miről is szól az ilyen “altruizmus”. Pedig kb. ua. a logikáról van szó, ami a hangyakolónia esetében is tettenérhető.
@fuhur: Én kezdek megbarátkozni ezzel a cikkel, bár természetesen volna még mit megvizsgálni ezzel kapcsolatban (l. 8-9.hsz).
Tegyük fel, hogy van egy olyan egyszerű gén, ami szinten próbálja tartani az indolt (gyakorlatilag a TnaA promóter). Ez nem lehetetlen, mert a vad típusú, lassú, meg gyors növekedésű is ~300 muM koncentrációt csinál alapesetben. Ha adsz hozzá antibiotikumot, akkor a vad meg a lassú termelése leesik, valszeg nem tudnak elég energiát feccolni a TnaA (és egyéb fehérjék) termelésbe, amit a cikkben a felülúszó fehérjéinek elemzése is jól mutat. Ekötben a rezisztens tudja termelni. Ha összekevered őket, akkor a rezisztensből kevesebb van, ezért ők megpróbálják feltornázni a TnaA szintet az eredeti szintre, akár erőn felül is. Gyakorlatilag a TnaA “szabályozó gén” védi a saját kópiáit a többi baciban. Ilyen értelemben az önző gén elmélet tényleg nem sérül, sőt! Nem is számít, hogy mutáns vagy nem mutáns baciban van a gén, tehát a szelekció nem egyed szinten történik.
Az zavart meg minket szerintem, hogy valódi altruizmus nem létezik a természetben, csak látszólagos. Hiszen altruizmus csak akkor jön elő, ha egyed szinten vizsgáljuk a dolgokat, ami meg egy kicsit erőltetett (bár néha hasznos) dolog.
Nekem is gondom van a jövőbe tekintő magyarázattal. Megpróbálom megfogalmazni, hogy mi, de laikusként ez nem biztos, hogy menni fog.
Ha jó értem, akkor külön gének kódolják a reztenciát és az altruista viselkedést. Ha ez a helyzet, akkor kétféle rezisztens egyed van: altrusita és nem altruista. Mivel az altruista több enregiát fordít TnA szekretálásra, kevésbé tud szaporodni, tehát hátrányba kerül az “önző” egyedekkel szemben. Nem látom, mi lehetne az, ami ezen önző egyedek elszaporodást adott pillanatban korlátozná, figyelembe véve, hogy az antibiotikum végig jelen van.
Akkor az előző hsz-omat vissza is vonnám gyorsan 🙂 Ugyanis azt feltételezi, hogy a TnaA termelő játékosok fel tudják ismerni, hogy melyik másik egyed hordozza a kópiáikat, és szelektíven tudja segíteni őket. Ami nagy valószínűséggel nem így van, hiszen oldatról beszélünk, ahol mindenkinek egyforma az indolkoncentráció.
Az a véleményem, hogy ez egy nagyon jó kísérlet az rezisztencia kialakulás kezdeti lépéseinek vizsgálatára. De ahhoz túl rövid, hogy lejátszott meccsről beszéljünk. Ott vannak a kísérlet vége felé (utolsó 2 napban) megjelenő mutációk, amiknek még nem is volt idejük elterjedni. És ki tudja, mi jöhet még! Bevallom, az egészből nekem csak azzal van bajom, hogy altruizmusról beszélünk egy olyan rendszerben, ami még messze nem ért el semmilyen egyensúlyt. Meg hogy egyáltalán altruizmusról beszélünk 🙂
Terjunk vissza arra, hogy a termesztben (tehet nem a steril laboratoriumi tiszta tenyeszetben) egy adott bakteriumsejt konyezteben milyen mas bakteriumok vannak?
Ha ket, vagy harom, vagy tobb kulonbozo bakterium is egyutt el, akkor kinek segit az altruista? Csak a sajat magahoz nagymertekben hasonloknak, vagy a versenytarsaknak is?
Valahol lehet elvesztettem a fonalat, és újra kellene olvasnom, de nem értem az egész mechanizmusát. A rezisztens mutáció a cikk szerint nem érinti a TnA termelés szabályozását. Akkor miért csak a rezisztens bacikban nőne meg a TnA termelés? Ez egy “logikus” válaszlépés lenne az összes többi baktérium részéről is, ha nem lettek rezisztensek, akkor még inkább.
A rezisztenciát okozó mutációknak valahogy kapcsolódniuk kell a TnA termeléshez a kísérlet alapján, de nem látok rá utalást, hogyan.
Ami nekem nem igazán jött át, hogy egyáltalán mi is tkp a TnA. Mert a cikk elején így ismerteti azt: “…hogy valóban akad egy ilyen fehérje, a triptofanáz enzimet kódoló TnA.”
Namármost annyit laikusként is tudok, hogy fehérje nem kódol semmit, géneket pedig nem szokás termelni és szétküldözgetni a vakvilágba, azokat legföljeb konjugáció útján csereberélik. De, mint ahogy egy másik mondatból kiderül, nem is volna szükség az adott gén terjesztésére, mert az alapból megvan minden egyedben.
Akkor tehát nem a triptofanáz enzimet termelik és szórják szanaszét inkább? De akkor meg miért az azt kódoló gént emlegeti a cikk következetesen?
@pirochatechin: jogos, javítottam. A TnA egy enzim, génként tnA lenne, dőltbeűvel és kis “t”-vel, ahogy a következő bekezdésben van. Az én slendriánságom a ludas.
Bearcheese:
“A rezisztens mutáció a cikk szerint nem érinti a TnA termelés szabályozását. Akkor miért csak a rezisztens bacikban nőne meg a TnA termelés?”
Ez mondjuk érthető, ha van egy kívánatos TNA szint a környezetben akkor amíg ez alacsony minden baci sokat termel, amikor magas akkor kevesebbet.
Ha jelen van az antibiotikum akkor csak a rezisztenseknek van energiájuk TNA-t termelni, mert a többi haldoklik. Aztán ha a rezisztensek megemelik a TNA-t azzal megmentik a többit. Ilyen értelemben valóban lehet alturizmusról beszélni. csak én azt nem látom, hogy eredetileg mi a célja a környezet tna szint szabályzásának, de valoszinüleg nem véletlenül csinálják mivel minden ejt termeli minden esetben, ha van antibiotikum, ha nem. Tehát valódi alturizmusról akkor beszélhetünk, ha a TNA semmi másra, nem jó mint az antibiotikumok kivédésére.
Jaj, de jó, hogy fölhívtátok a figyelmemet erre a cikkre! 🙂
Nem tudom, ezeket ismeritek-e, de témába vágnak és jók szerintem:
http://www.nature.com/nature/journal/v459/n7244/abs/nature07921.html
http://www.sciencemag.org/cgi/content/abstract/323/5911/272
Köszi, mindkettő szupernek és aktuálisnak tűnik!