Az ötlet mindig is viszonylag egyszerűnek tűnt: ha elromlik egy gén, cseréljük ki. Igen ám, de ami szépen fest az elméletben és a papíron számos technikai problémába ütközhet a valóságban.
Ugyanis, ahhoz, hogy egy-egy, az egész szervezetre kiható gén működését kijavítsuk, egyszerre kell két fontos problémával szembenéznünk. Egyrészt általánosságban meg kell oldani a hibátlan gén sejtbe való bejuttatásának kérdését, másrészt azt is biztosítani kell, hogy a beavatkozás eredményeként megfelelő számú sejt fejezi ki az egészséges gént.
 Utóbbira ma gyakorlatilag az egyetlen lehetőség, hogy egy olyan – a betegből származó – (felnőtt) őssejtet manipulálunk, amelyet a szervezetbe visszajuttatva képes megtelepedni és folyamatos osztódással számos (génmódosított) utódsejtnek életet adni.
Utóbbira ma gyakorlatilag az egyetlen lehetőség, hogy egy olyan – a betegből származó – (felnőtt) őssejtet manipulálunk, amelyet a szervezetbe visszajuttatva képes megtelepedni és folyamatos osztódással számos (génmódosított) utódsejtnek életet adni.
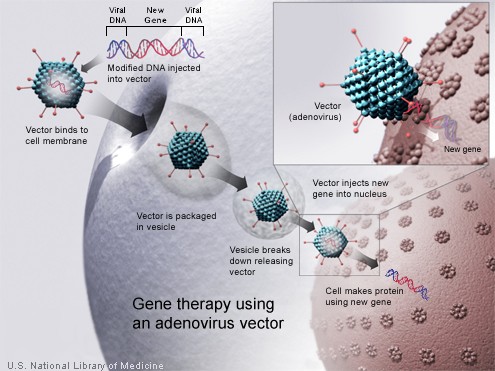
A módosításhoz pedig génmódosított vírusokat használunk. Bár ez az első pillanatban veszélyesnek hangzik, nem szükségszerűen az. Olyan vírusokról van ugyanis szó, amelyekben a saját virulenciájukhoz szükséges géneket az általunk bevinni kívánt egészséges génalléllel helyettesítünk. Így vírus nem tud elszabadulni és szaporodni, de arra képes lesz, hogy (módosított) genomját bejuttassa a sejtbe.
Két főbb víruscsaládot használnak erre a beavatkozásra: adenovírusokat és retrovírusokat. Utóbbiak genomja integrálódik majd a beteg sejtjének DNS-ébe, míg előbbiek örökítőanyaga csak a sejtmagba jut, de nem épül be. Mindkét vírust váltakozó sikerrel használták eddig, de különösen a retrovírusoknál (amelyeket a beépülésük miatt megbízhatóbbnak tartottak) néhány kísérlet eredménye ráirányította a figyelmet arra, hogy milyen veszélyekkel járhat egy ilyen beavatkozás.
Az ötlet mindig is viszonylag egyszerűnek tűnt: ha elromlik egy gén, cseréljük ki. Igen ám, de ami szépen fest az elméletben és a papíron számos technikai problémába ütközhet a valóságban.
Ugyanis, ahhoz, hogy egy-egy, az egész szervezetre kiható gén működését kijavítsuk, egyszerre kell két fontos problémával szembenéznünk. Egyrészt általánosságban meg kell oldani a hibátlan gén sejtbe való bejuttatásának kérdését, másrészt azt is biztosítani kell, hogy a beavatkozás eredményeként megfelelő számú sejt fejezi ki az egészséges gént.
 Utóbbira ma gyakorlatilag az egyetlen lehetőség, hogy egy olyan – a betegből származó – (felnőtt) őssejtet manipulálunk, amelyet a szervezetbe visszajuttatva képes megtelepedni és folyamatos osztódással számos (génmódosított) utódsejtnek életet adni.
Utóbbira ma gyakorlatilag az egyetlen lehetőség, hogy egy olyan – a betegből származó – (felnőtt) őssejtet manipulálunk, amelyet a szervezetbe visszajuttatva képes megtelepedni és folyamatos osztódással számos (génmódosított) utódsejtnek életet adni.
A módosításhoz pedig génmódosított vírusokat használunk. Bár ez az első pillanatban veszélyesnek hangzik, nem szükségszerűen az. Olyan vírusokról van ugyanis szó, amelyekben a saját virulenciájukhoz szükséges géneket az általunk bevinni kívánt egészséges génalléllel helyettesítünk. Így vírus nem tud elszabadulni és szaporodni, de arra képes lesz, hogy (módosított) genomját bejuttassa a sejtbe.
Két főbb víruscsaládot használnak erre a beavatkozásra: adenovírusokat és retrovírusokat. Utóbbiak genomja integrálódik majd a beteg sejtjének DNS-ébe, míg előbbiek örökítőanyaga csak a sejtmagba jut, de nem épül be. Mindkét vírust váltakozó sikerrel használták eddig, de különösen a retrovírusoknál (amelyeket a beépülésük miatt megbízhatóbbnak tartottak) néhány kísérlet eredménye ráirányította a figyelmet arra, hogy milyen veszélyekkel járhat egy ilyen beavatkozás.
2000-ben egy francia kutatócsoportnak sikerült igen súlyos immunzavarban (ún. SCID-ban) szenvedő gyerekeket retrovírus kezeléssel meggyógyítania. Legalábbis sokáig úgy tűnt, hogy sikerült, hiszen maga a betegség gyógyulófélben volt, de ekkor a kis betegek közül többen egy másik súlyos kór lépett fel: leukémia. Mint utóbb kiderült, ez azért ütötte fel a fejét, mert a retrovírus beépülésekor néhány más gén mutálódott, és így hiába javítottak ki egy hibás gént, ha közben egy másikat elrontottak. Ma már azt is tudni lehet, hogy több retrovírus genomba való beépülése egyáltalán nem véletlenszerű (mint azt korábban feltételezték), hanem előszeretettel épülnek be más gének szabályozó-, vagy éppen fehérje kódoló régióiba (ennek a miértjére még nincs pontos válasz), ami értelemszerűen nem veszélytelen. Bár a helyzet cseberből-vederbe esetnek tűnik, mégsem teljesen az: ugyan nyilvánvalóvá vált, hogy a génterápia komoly veszélyeket rejt magában, ugyanakkor azon betegek számára, akiken alkalmazzák, ez az egyetlen esély. Enélkül biztos meghalnak, így általában mégis érdemes felvállalni a mellékhatásokat.
Most egy másik csoport a retrovírusokkal nem egy elromlott gén egészséges variánsát juttatta be a szervezetbe, hanem valami teljesen újra tanította meg az immunválaszért felelős sejteket: miként harcolhatnak hatékonyabban a rák ellen. Egész pontosan egy olyan receptort juttattak be a T-sejtekbe, amely képes felismerni a rákos melanóma sejteket. A kezelt betegek végső stádiumú rákban szenvedtek, de az a két páciens, akinél a visszajuttatott sejtek megmaradtak a szervezetben néhány hónapon belül teljesen meggyógyult (a szomorú rész, hogy a másik 13 beteg nem volt ilyen szerencsés)!
Az eredmény azonban nemcsak a bőrrák szempontjából lehet igen fontos: hasonló elven még egy sor más tumoros betegség is kezelhetővé válna. Már csak arra kellene rájönni, miként javítható a visszajutattott T-sejtek életbenmaradásának aránya…
Morgan, RA, Dudley, ME, Wunderlich, JR, Hughes, MS, Yang, JC, Sherry, RM, Royal, RE, Topalian, SL, Kammula, US et al. (2006) Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes. Science doi: 10.1126/science.1129003
Wu X, Li Y, Crise B, Burgess SM. (2003) Transcription start regions in the human genome are favored targets for MLV integration. Science 300: 1749-1751.
Marshall E. (2002) Clinical research. Gene therapy a suspect in leukemia-like disease. Science 298: 34-35.
Cavazzana-Calvo M, Hacein-Bey S, de Saint Basile G, Gross F, Yvon E, Nusbaum P, Selz F, Hue C, Certain S, Casanova JL, Bousso P, Deist FL, Fischer A. (2000) Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease. Science 288: 669-72.
