 A jelenleg is zajló járvány miatt szinte naponta olvashatunk arról, hogy mi is a pillanatnyi helyzet a vírustesztekkel, mi jött be, mi nem jött be, mi maradt ki, mennyi időbe telik? Láthatóan a sajtóban teljes a tanácstalanság, hogy melyik hogyan működik, ezért gondoltam, érdekes lehet összefoglalni, hogy milyen módszerekkel mutathatunk ki egy vírust?
A jelenleg is zajló járvány miatt szinte naponta olvashatunk arról, hogy mi is a pillanatnyi helyzet a vírustesztekkel, mi jött be, mi nem jött be, mi maradt ki, mennyi időbe telik? Láthatóan a sajtóban teljes a tanácstalanság, hogy melyik hogyan működik, ezért gondoltam, érdekes lehet összefoglalni, hogy milyen módszerekkel mutathatunk ki egy vírust?
A dolog nem is olyan egyszerű, mint első látásra tűnik, éppen a vírusok tulajdonságai okán. Egyrészt a vírusokat általában nem tartjuk élőlényeknek, önmagukban szaporodásképtelenek, csak a gazdasejt életműködéseit eltérítve sokszorozhatják meg önmagukat. Ezzel ki is lőhetjük a kézenfekvő megoldást, ami egy baktériumnál működne: Bármilyen táptalajra helyezünk egy vírust önmagában, az egyszerűen csak megdöglik, szaporodni nem fog. Egy baktérium azonosítható viszonylag egyszerűen úgy, hogy egy kocsonyás táptalajra szélesztjük, majd megfigyeljük, milyen telepeket alkotnak a felszaporodó baktériumsejtek. Egy vírusnál ez az egyszerű módszer nem működik. Másrészt a vírusok rendkívül apróak (20-300 nanométeresek), így nem láthatóak fénymikroszkóppal, azaz kiesett az a kézenfekvő azonosítási módszer is, hogy valamilyen festékkel megfestenénk egy mintát és egy mikroszkópba téve megszemlélnénk őket. De mit lehet akkor tenni egy vírussal?
Tenyésztés
A vírusok ugyan önmagukban nem szaporodóképesek, de emberi sejtekben könnyedén megsokszorozzák magukat. Számos halhatatlan daganatsejtvonalat tartanak fönn laboratóriumokban, ezek a sejtek korlátlanul osztódnak tápoldatokkal töltött műanyagedényekben is. Egy ilyen sejttenyészetet is fertőzhetünk a betegektől vett vírusmintával és a vírusok a daganatsejtekben éppen úgy szaporodnak, mint egy élő emberben tennék. A sejttenyészet sejtjei viszont nagyon is jól láthatóak fénymikroszkópban is, az ő pusztulásukat figyelve követhetjük a vírus szaporodását is.
Előnyök:
-Általános módszer: Semmit sem kell tudni a vírusról ahhoz, hogy sejtvonalakat fertőzzünk velük. Egy induló járvány legelső betegétől vett minta is azonnal felhasználható, amikor még az orvosok is legföljebb gyanakodnak, hogy vírusfertőzésről lehet szó.
Hátrányok:
-Lassú: Egy ilyen sejttenyészetben jó pár napba telik, mire láthatóan pusztulni kezdenek a sejtvonal sejtjei. Egy kórházban, ahol egy éppen beszállított betegről kellene kimutatni, hogy mi a baja, ez sokszor túl hosszú idő.
-Általános eredményt ad: Az, hogy egy vírus elpusztította a műanyag edényben növő sejteket, önmagában nem sok adatot szolgáltat. A legtöbb vírus pont ugyanolyannak látszik ilyenkor, az, hogy itt egy beteg, akinek a garatváladékából egy vírust mutattunk ki, de egyetlen ismert vírussal sem fertőzött nyilván kutatói szemszögből érdekes, de gyógyászati felhasználásra nem alkalmas. (Egyébként akadnak kivételek is, például az emberi RSV vírus a fertőzött gazdasejteket összeolvasztja, sokmagvú óriássejteket hoz létre belőlük, ami alapján azonosítható.)
-Fertőzőképes: A sejttenyészetben szaporodó vírusok éppen olyan fertőzőképesek, mint az emberekben tenyészők, ezeket a munkákat csak a legnagyobb körültekintéssel végzik, pont erre képzett szakemberek. Ennek következtében a módszer drága és nehézkes hirtelen megnövelni az ezzel foglalkozó laborok számát, hiszen képzetlen emberek ilyen környezetben könnyen súlyosbítják a helyzetet.
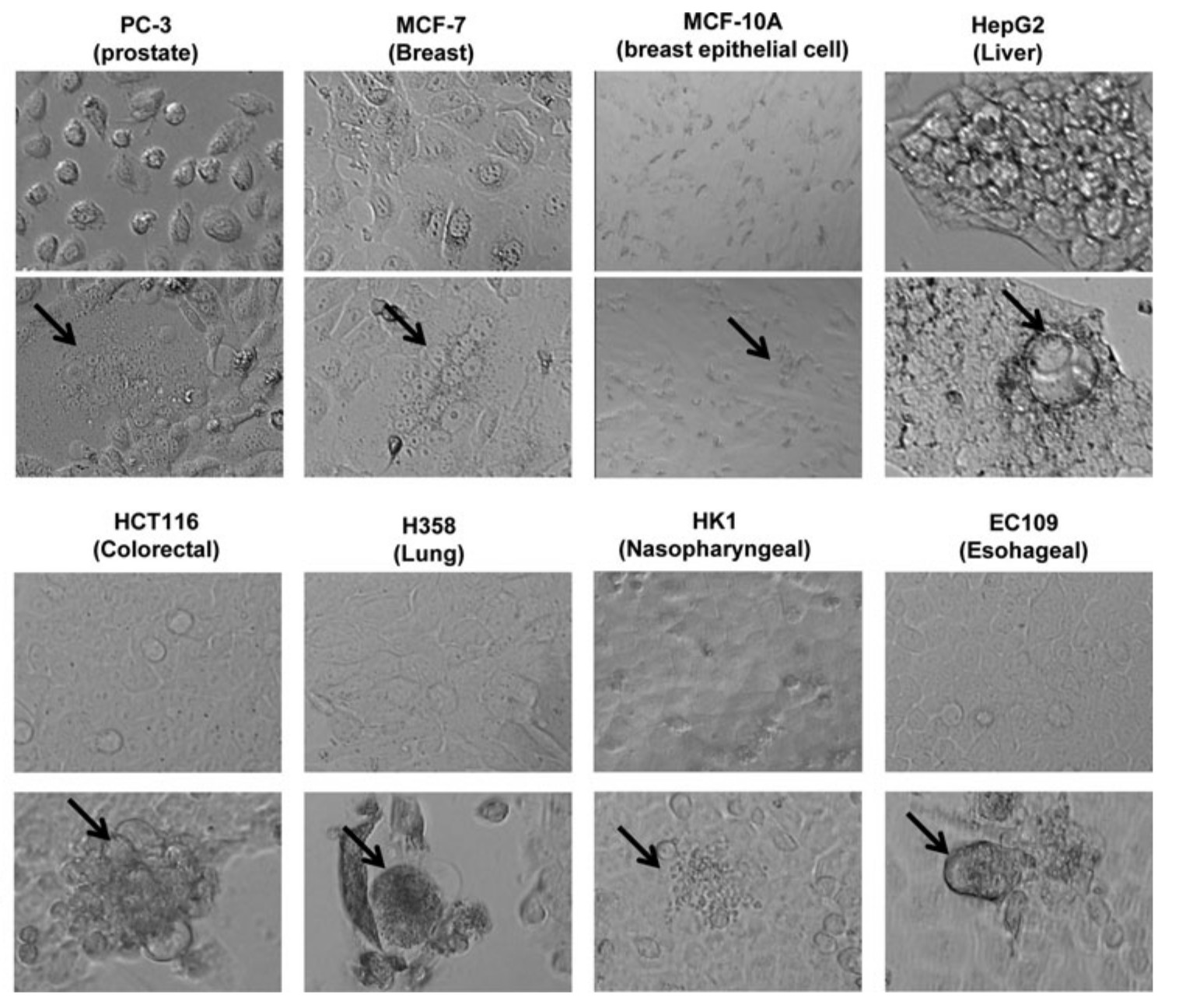
Az első ábrán egy ilyen kísérlet látható. A feltüntetett nyolc különböző sejtvonalat (PC-3, MCF-7, MCF-10A, HCT116, H358, HK1, EC109) fényképezték le önmagukban (fölső sor) és a kanyaró és a mumpsz vírusával fertőzve (alsó sor). (Son és mtsai. 2018)
A vírus örökítőanyagának a kimutatása
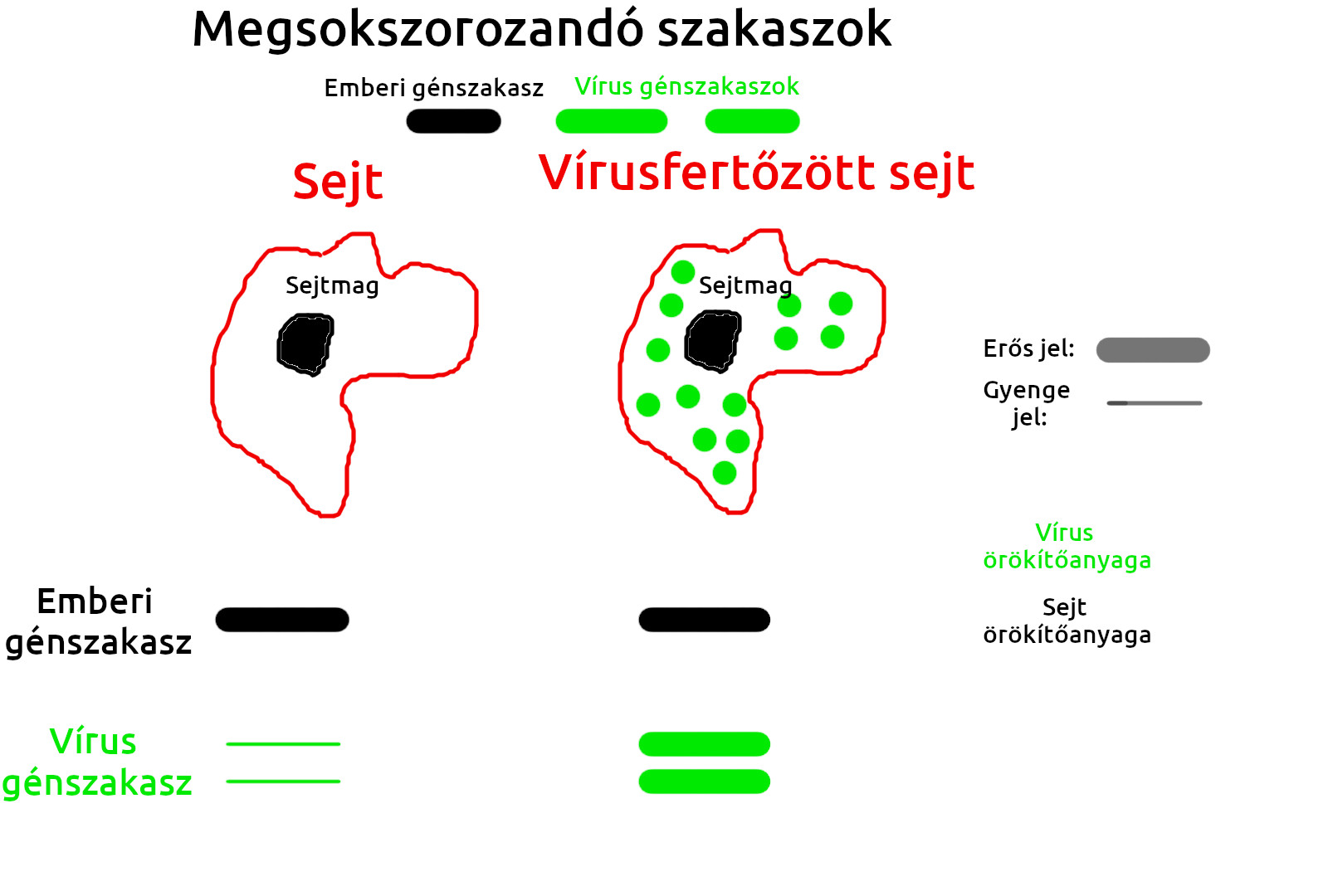
Ezeket emlegetik a sajtóban PCR, qPCR, RT-PCR vagy éppen nukleinsav-erősítéses tesztekként. Az alapja a polimeráz láncreakció, egy módszer, amivel ha ismerjük egy rövidebb DNS szakasz elején és végén körülbelül húsz-húsz bázis pontos sorrendjét, akkor az egész szakaszt megsokszorozhatjuk gyakorlatilag korlátlanul. Mivel a sokszorozás ismert ütemben zajlik, a kiválasztott DNS szakasz megkettőződik a láncreakció minden lépésében, vagyis a termelődő DNS mennyisége arányos lesz a mintaként használt DNS mennyiségével (ha a mintában sok példány úszott a vírus örökítőanyagából, gyorsabban felszaporodik a vizsgált két génszakasz). A vizsgálathoz szükséges gép annyit tesz, hogy elvégzi ezt a sokszorozást és közben folyamatosan méri a keletkező DNS mennyiségét, ebből egy számértéket is ad arra, hogy az eredeti minta hány darab DNS molekulát tartalmazott a vizsgált szakaszból.
Egy ilyen mérés során mi döntjük el, hogy melyik szakaszt szeretnénk megsokszorozni, a mintában található összes többi örökítőanyag nem zavarja a mérést, sok-sok milliárd bázispárnyi DNS között is megtalálja az általunk kívánt néhány száz bázispár hosszúságú szakaszt. Így használható például vírusok kimutatására: A COVID19 tesztek a leggyakoribb elrendezésben két vírus gén egy-egy szakaszát sokszorosítják és egy emberi gén egy szakaszát. Az emberi gén szakasza ad egy alapértéket, azt tudjuk, hogy egy mintában ebből hány példányt várunk, hiszen ezt a vírusfertőzés nem érinti, egészségesekben és betegekben is ugyanannyi példány várható belőle.
Ehhez képest tudjuk megmondani, hogy a vírus örökítőanyagából viszonylagosan mennyi található a mintában? Ha az emberi örökítőanyagban található szakasz mennyiségéhez képest sok található a mintában a vírus örökítőanyagában található szakaszokból, akkor kimondhatjuk, hogy a mintaadó beteg, mert a vírus örökítőanyaga is jelen van a saját örökítőanyaga mellett. Ha szinte elhanyagolható mennyiségű a vírus örökítőanyagában található szakaszok mennyisége, akkor kimondhatjuk, hogy a mintaadó nem fertőzött, mivel a vírus örökítőanyagát nem találtuk meg a mintában. (Ha az emberi örökítőanyagban található szakaszból volt elhanyagolható mennyiségű, akkor pedig a mintavétel során történt hiba.)
Ezt mutatja a második ábra.
Előnyök:
-Kevés előzetes adat kell hozzá: Ha a vírus néhány génjének ismert a bázissorrendje, már működik. Ez régebben komoly akadályt jelentett, manapság egy vírus genom bázissorrendjének meghatározása ujjgyakorlat számos laborban.
-Nem igényel élő vírusokat: A mintavétel után a mintát egy olyan oldatba helyezzük, amiben a vírus azonnal elpusztul, ám ami megvédi az örökítőanyagát.
-Elfogadható sebességű: Egy minta feldolgozása a végső eredményig három-négy óra. Jól megszervezett mintavételi rendszerben a reggel levett mintából már délutánra eredmény várható.
-A szükséges anyagok könnyen beszerezhetőek: Mivel a szükséges gépet és a szükséges anyagokat sok vizsgálathoz használják, kifejezetten nagy gyártókapacitás áll rendelkezésünkre.
-Gyorsan elkészíthető: Ahogy megismerjük a vírus genomját, napok alatt elkészíthetőek a teszthez szükséges anyagok (rövid DNS szakaszok). A jelenlegi járványban is megfigyelhető ez, az ilyen típusú tesztek már néhány héttel a járvány elindulása után bevethetőek.
-Érzékeny: Mivel a vírus örökítőanyagát mutatja ki a vizsgálat, ebből is egészen kis mennyiség elegendő, a nagyon korai fertőzéseket is kimutatja ez a mérés. Napra vagy órára ezt jelenleg nem tudjuk lefordítani, ehhez nincs elég adatunk a vírusról.
Hátrányok:
-A kezdeti befektetés magas: Egy ilyen qPCR gép több millió forintba kerül amit az előtt kell kifizetni, hogy egyetlen vizsgálatot is elvégeznének.
Ellenanyag alapú módszerek I.: Áramlási citometria
A gerinces immunrendszer működésének alapja, hogy a szervezet olyan fehérjéket termel, amik vizes oldatban felismerik a támadó kórokozót és erősen hozzákötnek. Ezeket nevezzük ellenanyagoknak. Egy adott ellenanyag egyetlen apró molekuláris mintázatot ismer föl ezekhez a módszerekhez nyilván olyan ellenanyagokat használnak, amik a kimutatandó vírus valamilyen fehérjéjét ismerik fel. Ezek az ellenanyagok a vírus fehérjéit mutatják ki.
Ha elkészítünk egy festékkel jelölt ellenanyagot, ami egy vírus valamelyik fehérjéjét ismeri fel, akkor a legegyszerűbb felhasználásként megtehetjük, hogy a vizsgálandó betegtől vért veszünk, hozzáadjuk a beteg fehérvérsejtjeihez, majd lemossuk a nem kötött festéket és a megfelelő hullámhosszú fénnyel gerjesztjük a festéket. A vírusfertőzött sejtek felszínén megjelennek a vírus fehérjéi is, ezekhez kötődik a festett ellenanyagunk ami így a vizsgált sejtekhez kötődik. A gerjesztő fény hatására a vírusfertőzött sejtek világítanak, a nem fertőzött sejtek nem. Ezt mutatja a következő ábra.
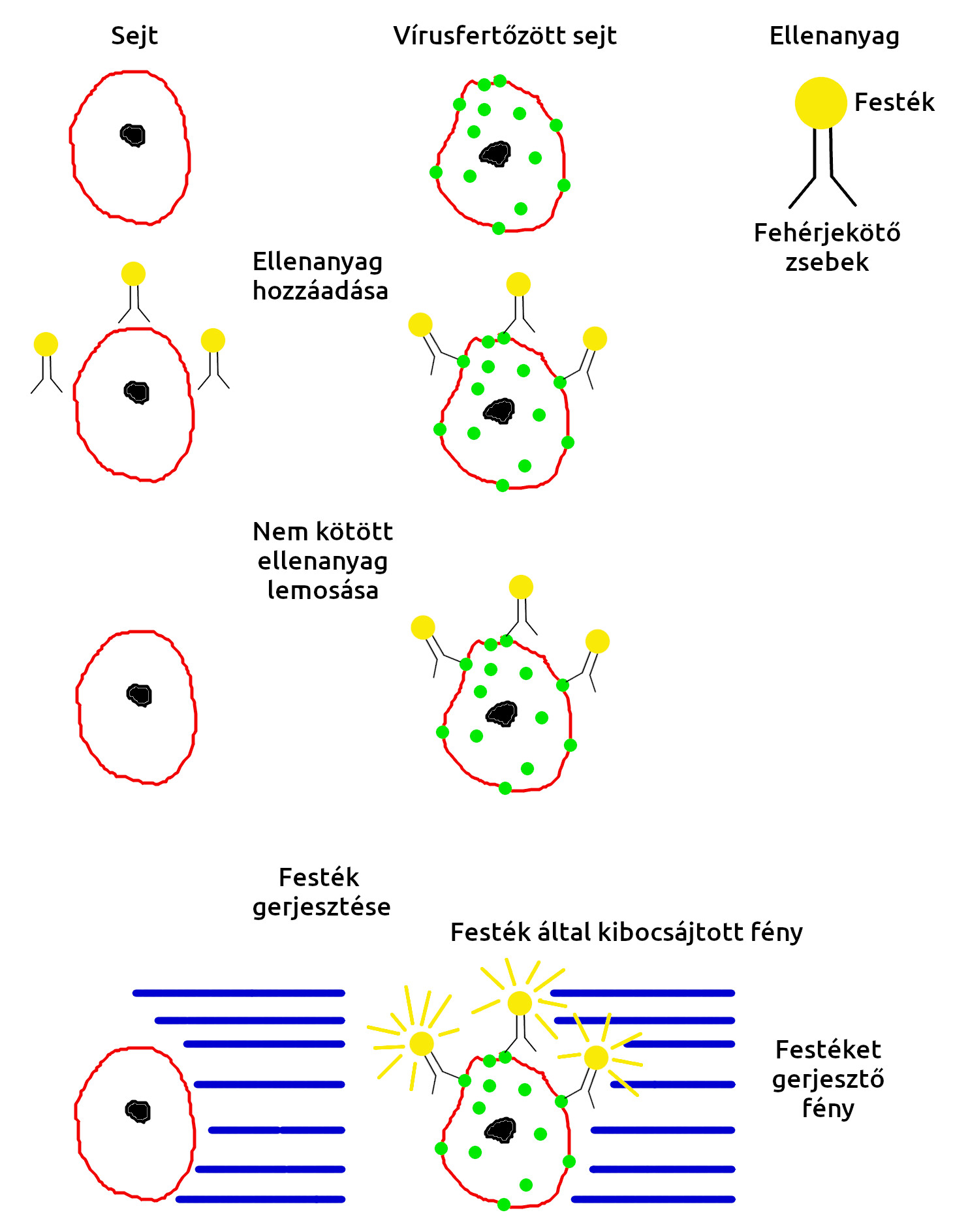
Előnyök:
-Rendkívül gyors: Néhány óra alatt elvégezhető a vizsgálat.
-Érzékeny: Jól megválasztott ellenanyaggal egyértelműen elkülöníthetőek a fertőzöttek az egészségesektől.
Hátrányok:
-A kezdeti befektetés magas: Egy ilyen áramlási citométer több millió forintba kerül amit az előtt kell kifizetni, hogy egyetlen vizsgálatot is elvégeznének.
-Fehérvérsejteken működik: Ebben a legegyszerűbb változatában ez az ellenanyagfestés csak vérsejteken működik, egy olyan vírus kimutatására, ami ezeket éppen nem fertőzi nem alkalmas. Például ilyen a most járványt okozó COVID19 vírus is.
-Ellenanyagfüggő: Jól megválasztott ellenanyaggal, ami erősen köt a vírusfehérjéhez, más fehérjékhez meg nem, a módszer jól működik. Egy nem olyan kitűnő ellenanyaggal, ami mondjuk gyengén köt a vírusfehérjéhez, a teszt megbízhatósága is romlik.
-Ellenanyagot igényel: Egy ilyen ellenanyag egy véletlenszerű génátrendeződés eredménye. Egy ilyen sejtvonal elkészítése, ami az ellenanyagot termeli, hónapokba telik. A dolog természetéből fakadóan számtalan cég számtalan különböző ellenanyaggal vág neki a piacnak és majd hónapok alatt derül ki, hogy melyik működik a legjobban.
-Kevéssé érzékeny: Mivel a módszer működéséhez számos, a vírusfehérjéket termelő sejt szükséges, ez a módszer általában később mutatja ki egy vírus jelenlétét, mint a PCR alapú tesztek.
Ellenanyag alapú módszerek II.: ELISA
Bár elsőre annak tűnik, ELISA nem egy női név, hanem egy fehérjekimutatási módszer neve. Akkor alkalmazható, ha nincs olyan szerencsénk, hogy a vizsgált vírus valamilyen könnyen elkülöníthető sejttípust fertőz. Ilyenkor a levett mintát fel kell tárnunk, vagyis a benne lévő sejteket szétroncsoljuk, az így kapott oldatot pedig egy olyan műanyaglemezre helyezzük, ami válogatás nélkül minden fehérjét megköt. Ekkor az előbbi módszerhez hasonlóan megfestjük egy ellenanyaggal, ami egy vírus eredetű fehérjét ismer fel. Azonban ehhez az ellenanyaghoz nem világító festéket kötünk, hanem egy másik fehérjét, ami egy kémiai reakciót végez el (ezeket a biokatalizátorokat hívjuk enzimeknek), amivel egy vizes oldatban egy színtelen molekulát elhasítva színes terméket hoz létre. Az ellenanyag az oldatban felismeri a vírusfehérjét és hozzákötődik. Ezek után lemossuk a nem kötött ellenanyagot és hozzáadjuk a molekulát, amit az ellenanyaghoz kötött enzim elhasít. Így azokban a mintákban, amelyek vírusfehérjéket is tartalmaztak, megszínesedik az oldat, mégpedig a vírusfehérje mennyiségével arányosan, minél több vírus volt az eredeti mintában, annál sötétebb színt kapunk. A szín erősségét egy erre szolgáló géppel lemérve azt is megtudhatjuk, mennyi vírusfehérjét tartalmazott az eredeti minta. Ezt mutatja a következő ábra. Eddig nem találkoztam ezen az elven működő, piacon kapható ELISA teszttel, amit COVID19 kimutatására terveztek, de a piac szó szerint hétről hétre változik, nem lehetetlen, hogy valaki ilyet is árul.
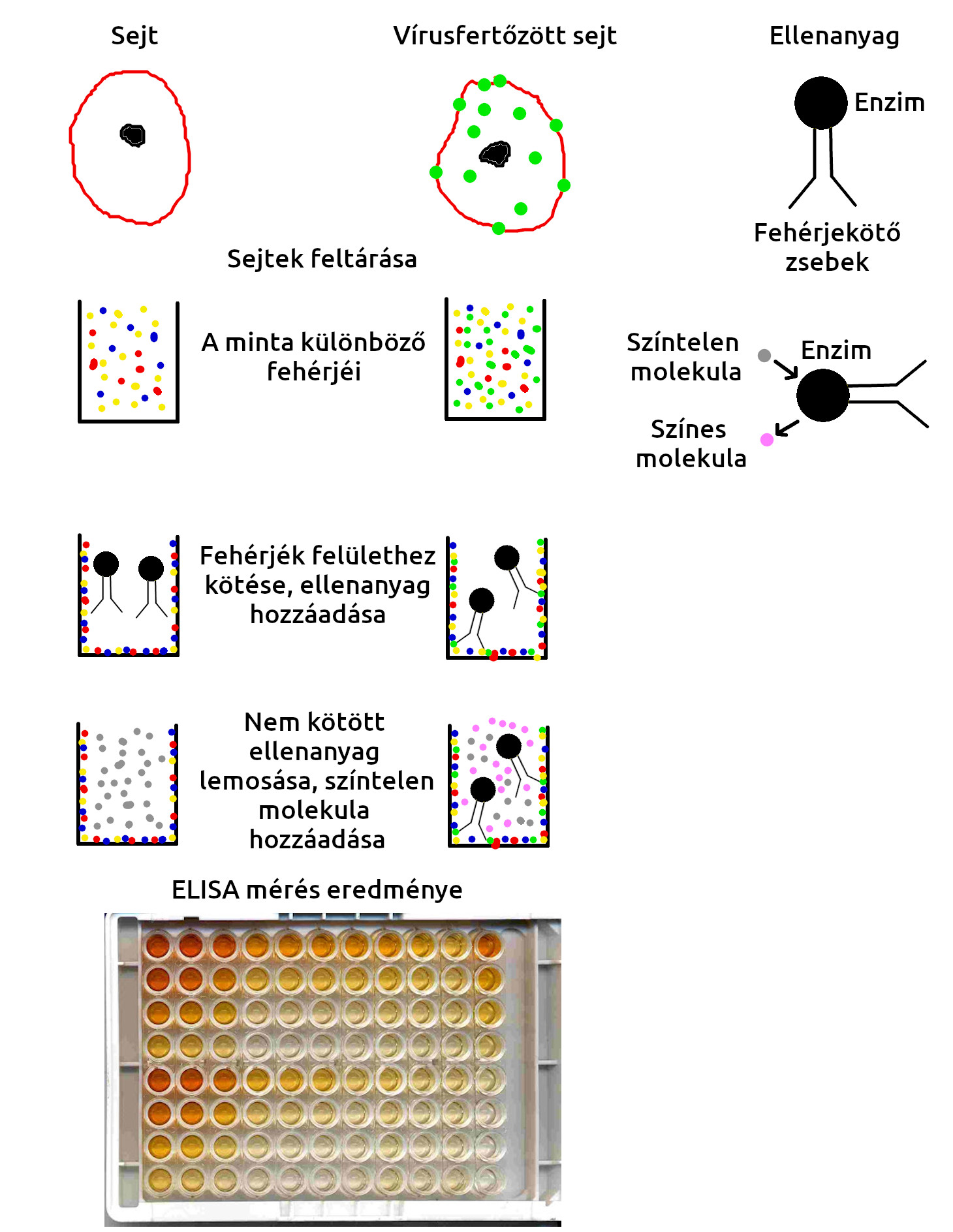
ELISA mérés ábrája és a végeredménye: Az ellenanyaghoz kötött enzim egy színtelen molekulát színes termékké bont. A színes termék mennyisége mérhető, ebből kimutatható, mennyi vírusfehérjét tartalmazott a minta.
Előnyök:
-Gyors: Néhány óra alatt elvégezhető egy ilyen mérés.
Hátrányok:
-Ellenanyagfüggő: Jól megválasztott ellenanyaggal, ami erősen köt a vírusfehérjéhez, más fehérjékhez meg nem, a módszer jól működik. Egy nem olyan kitűnő ellenanyaggal, ami mondjuk gyengén köt a vírusfehérjéhez, a teszt megbízhatósága is romlik.
-Ellenanyagot igényel: Egy ilyen ellenanyag egy véletlenszerű génátrendeződés eredménye. Egy ilyen sejtvonal elkészítése, ami az ellenanyagot termeli, hónapokba telik. A dolog természetéből fakadóan számtalan cég számtalan különböző ellenanyaggal vág neki a piacnak és majd több hónapnyi használat után derül ki, hogy melyik működik a legjobban.
-Kevéssé érzékeny: Mivel a módszer működéséhez a vírusfehérjéket termelő sejtek szükségesek, ez a módszer általában később mutatja ki egy vírus jelenlétét, mint a PCR alapú tesztek.
Ellenanyag alapú módszerek III.: Lateral flow test
Ezt a módszert hívják a sajtóban gyorstesztnek, tesztkazettának, ellenanyagtesztnek vagy vértesztnek. Ennek a működtetéséhez is ellenanyagok szükségesek, de más elven működik mint a fenti módszerek: A vírusfertőzés során a szervezetünk sem tétlenkedik, előbb-utóbb mi is ellenanyagokat termelünk a vírus leküzdésére. A rendszer alapja, hogy a vírus valamelyik jellemző fehérjéjét megtermeltetik (általában génmódosított baktériumokban) és aranyszemcsékhez kötik. Ezt mutatja ki ez a vizsgálat. A vírusfehérjével borított aranyszemcséket egy vékony réteg nagy felületű ásványi porral borított lemezre juttatják. A vizsgált betegből egy csepp vért a lemezre csöppentve, majd némi vivőoldatot rácsöppentve, a folyadék a hajszálcsövesség elve alapján elindul, hogy benedvesítse az egész lemezt. Mivel a lemezre a vér bejuttatásától nézve folyásirányban lefelé vitték föl a vírusfehérjével borított aranyszemcséket, ahogy a folyadék benedvesíti a lemez ezen részét, a vérben található vírus elleni ellenanyagok felismerik az aranyszemcséket, kötődnek hozzájuk, így együtt vándorolnak tovább a lemezen. Ha akadnak ilyenek a vérben. Egy fertőzött ember immunrendszere állít elő ellenanyagokat a vírus felismerésére, egy egészséges emberé nem, egy egészséges ember immunrendszere is számtalan ellenanyagot termel ugyan, de ezek nem ismerik fel az adott vírus fehérjéit, így egyszerűen elúsznak az aranyszemcsék mellett.
A lemez kiértékelhető részén egy keskeny csíkban olyan bevonatot tartalmaz, amely az emberi ellenanyagokat ismeri fel, ezeket a lemezhez köti. Amikor a vérmintából származó ellenanyagokat idejuttatja a hajszálcsövesség, ezeket megkötik a lemez bevonata. Amennyiben a vérminta fertőzött emberből származik, az itt megkötődő ellenanyagok magukkal hozzák az aranyrészecskéket is, amikhez kötődnek, ha ezek közül sok egymás mellé igazodik, látható piros színt eredményeznek, vagyis ilyenkor a gyorsteszt azon sávjában, ahová az emberi ellenanyagok kötődnek, megjelenik egy piros csík. Ha egészséges ember vérmintája került a lemezre, a hajszálcsövesség elve ugyanúgy működik, semmi sem akadályozza az aranyszemcséket, hogy továbbússzanak a lemez végéig, nem sűrűsödnek össze egy viszonylag szűk sávban, így nem is hoznak létre színes csíkot. Ezért nevezik ezt gyorstesztnek, mert szó szerint percek alatt elvégezhető, az eredmény a csupasz szemünkkel leolvasható.
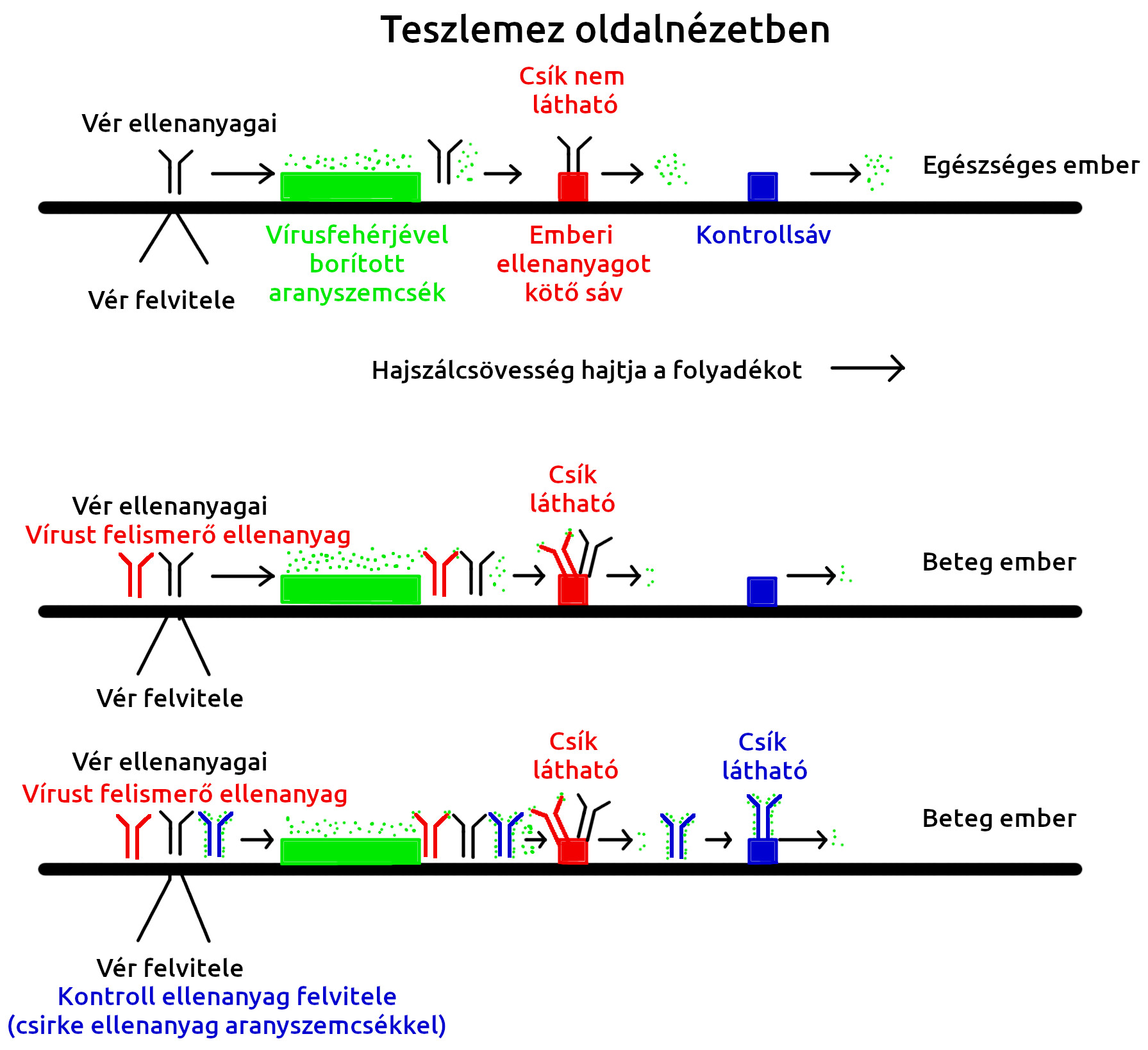
Ezekre a tesztekre egy kontrollcsíkot is szokás nyomni, ez minden esetben megpirosodik, akár vírusfertőzött ember adta a mintát, akár egészséges. Ez a fent leírt folyamattól függetlenül működik, a lemez a kontrollsávjának a területén csirke ellenanyagokat felismerő bevonatot kap. Ugyanis a sóoldat, amit a vércseppre csöppentenek csirke ellenanyagokat is tartalmaz, amikhez eleve hozzákötöttek aranyrészecskéket. Ezeket ugyanúgy magával ragadja a hajszálcsövesség, ugyanúgy végigsodorja a lemez egész felületén, de ezek semmilyen kölcsönhatásba sem lépnek se a vírusfehérjékkel borított aranyszemcsékkel, se az emberi ellenanyagot felismerő sávval, ellenben megkötődnek a csirke ellenanyagokat felismerő sáv területén és a rájuk kötött aranyrészecskékkel létrehozzák a szemmel látható kontrollcsíkot. Ez azt jelzi, hogy a lemezen az ellenanyagok már túljutottak az emberi ellenanyagokat felismerő sávon, ha eddig nem gyűltek oda az aranyrészecskék, akkor már nem is nagyon fognak.
Egyes teszteken nem egyetlen tesztcsík található, hanem kettő, egy IgM és egy IgG. Ugyanis az emberi immunrendszer különböző ellenanyagokat termel, a fertőzés elején, a betegség után körülbelül egy héttel IgM ellenanyagokat termel, amik aztán néhány hét alatt eltűnnek a vérből. Ellenben a betegségkezdete után körülbelül két héttel a vérben IgG ellenanyagok is megjelennek, amik éveken, évtizedeken át megmaradnak. Hogyha egy ilyen lemezre nem csak úgy általában emberi ellenanyagokat kötő csíkot nyomnak, hanem külön csíkokban emberi IgM és IgG ellenanyagokat felismerő bevonatot kap, akkor még azt is megmondhatjuk, hogy a fertőzött ember vérében IgM és/vagy IgG ellenanyagok keringenek -e? Ha csak IgM ellenanyagokat mutatunk ki, akkor a fertőzés viszonylag friss, mivel még az immunválasz elején jár a szervezet, nem termel IgG ellenanyagokat. Ha IgM és IgG ellenanyagokat is kimutathatunk, akkor a fertőzés két hétnél régebbi, de még viszonylag friss. Ellenben ha csak IgG ellenanyagokat mutathatunk ki, akkor az egy régebbi fertőzésre utal, az immunválasz olyan régen lezajlott, hogy a vérből már eltűntek az IgM ellenanyagok.
Előnyök:
-A leggyorsabb módszer: Percek alatt elvégezhető vizsgálat.
-Érzékeny: Jól megválasztott vírusfehérjével egyértelműen elkülöníthetőek a fertőzöttek az egészségesektől.
-Nem igényel műszert: Semmilyen befektetés sem kell hozzá, egy tesztkazetta megvételével azonnal kezdődhet is a vizsgálat.
Hátrányok:
-Vírusfehérjefüggő: A vizsgálat központi eleme, hogy milyen vírusfehérjét kötnek az aranyszemcsékhez? Ha olyan fehérjeszakaszt sikerül kiválasztani, ami ellen sokak immunrendszere termel ellenanyagot, akkor a vizsgálat pontossága magas. Ha nem, akkor bizony rohamosan csökken.
-Immunválaszfüggő: Mivel a teszt nem magát a vírust mutatja ki, hanem az immunrendszer vírus ellen termelt ellenanyagait, így bizonytalanságot visz a rendszerbe, hogy minden immunválasz során újonnan történő, véletlenszerű génátrendeződések hozzák létre az ellenanyagokat kódoló géneket, így minden immunválasz kicsit más, mint a többi.
-Késői fertőzést mutat ki: Mivel a teszt a vírus ellen termelődő ellenanyagokat mutatja ki, csak a fertőzés után hetekkel kezd a beteg pozitív mintákat adni, így karanténintézkedésekre nem alkalmas.
Ellenanyag alapú módszerek IV.: ELISA vérből
Az előbb említett ELISA módszernek létezik COVID19 vírus kimutatására alkalmas, kereskedelmi forgalomban is kapható változata, tucatnyi cég gyárt ilyet is. Ennek a működési elve a gyorstesztére hasonlít inkább: Olyan műanyaglemezeket árulnak, amikre eleve a vírus valamilyen fehérjéjét (általában génmódosított mikróbákban termeltet), kötöttek. Erre a vizsgált személy sejtmentes vérét fölvive, ha a vérben találhatóak ellenanyagok, amik felismerik a vírusfehérjét, azok kötődnek a vírus fehérjéhez. Ekkor ha olyan enzimekhez kötött ellenanyagot adunk hozzá, amely az emberi ellenanyagokat ismeri fel, ugyanúgy kimutathatóak az ellenanyagok, mint a korábban leírt ELISA módszerrel.
Előnyök:
-Gyors: Néhány óra alatt eredményt ad.
-Érzékeny: Jól megválasztott vírusfehérjével egyértelműen elkülöníthetőek a fertőzöttek az egészségesektől.
Hátrányok:
-Vírusfehérjefüggő: A vizsgálat központi eleme, hogy milyen vírusfehérjét kötnek a műanyaglemezhez? Ha olyan fehérjeszakaszt sikerül kiválasztani, ami ellen sokak immunrendszere termel ellenanyagot, akkor a vizsgálat pontossága magas. Ha nem, akkor bizony rohamosan csökken.
-Immunválaszfüggő: Mivel a teszt nem magát a vírust mutatja ki, hanem az immunrendszer vírus ellen termelt ellenanyagait, így bizonytalanságot visz a rendszerbe, hogy minden immunválasz során újonnan történő, véletlenszerű génátrendeződések hozzák létre az ellenanyagokat kódoló géneket, így minden immunválasz kicsit más, mint a többi.
-Késői fertőzést mutat ki: Mivel a teszt a vírus ellen termelődő ellenanyagokat mutatja ki, csak a fertőzés után hetekkel kezd a beteg pozitív mintákat adni, így karanténintézkedésekre nem alkalmas.
Mit szűrhetünk le ebből a jelenlegi COVID19 járványra vonatkozóan?
A világsajtóban az év eleje óta forrón vitatott kérdés, hogyan teszteljünk, mit teszteljünk, mennyit teszteljünk, mikor teszteljünk? De mint ebből a kis összefoglalóból is látszik, egy új járvány kitörésekor a lehetőségeink nagyon korlátozottak. December végén észlelték Kínában az első betegeket, Január közepén már közzé is tették a vírus teljes genomját, valószínűleg jelenleg ennél gyorsabban nem lehetett volna ezt megtenni.
Egy a vírust felismerő ellenanyag előállítása hónapokba telik, amikortól az első vírusmintákat beazonosítják, onnantól negyedév mire egyáltalán elkezdhetnek gyártani bármilyen tesztet, ami a vírust felismerő ellenanyagokat igényel.
Manapság a vírus fehérjéket igénylő módszerek lényegesen gyorsabban elkészülnek, egy vírusfehérjét termelő génmódosított baktérium napok alatt elkészül. Ám az, hogy az a bizonyos fehérjeszakasz jó választásnak bizonyult -e, a betegek nagy része ellenanyagot termel -e ellene, az bizony csak a használat során derül ki. Ez régebbi betegségek esetén úgy működik, hogy rendszeresen összehasonlítják az egyes gyártók termékeit és hónapok, talán évek alatt kiderül, melyik termék működik a legjobban. Most azonban több tucat cég kezdett ilyeneket gyártani, amik közül egyikkel sincs senkinek sem tapasztalata. Lehet, hogy működik, lehet, hogy nem, egyelőre nincsenek velük terepi tapasztalatok. Biztosan akad köztük, amelyik nem működik, ezekről szólnak azok a sajtóhírek, amik ″használhatatlan koronavírusteszt″ -ről szólnak. Ez nem azt jelenti, hogy a módszer eleve nem működik, hanem hogy például a legtöbb beteg szervezete nem pont az ellen a fehérjeszakasz ellen termel ellenanyagokat, amiket a gyártó felhasznált. Ezeknek az előrejelzésére nem létezik holtbiztos módszer, mivel ugye minden egyes ember immunválasza kicsit különbözni fog a többiekétől.
A PCR alapú azonosítási módszereket viszonylag gyorsan piacra dobta több gyártó is, ezek előnye, hogy nem ellenanyagokkal működnek, így nem kell arra várni, hogy véletlenszerű génátrendeződések létrehozzák a fő alkotóelemét, az ehhez szükséges anyagok tervezhetőek. Nem véletlenül ezek a vizsgálatok valósultak meg eddig is a világban mindenhol, ahol nagyobb mennyiségben szűrtek embereket.
Son, H. A., Zhang, L., Cuong, B. K., Van Tong, H., Cuong, L. D., Hang, N. T., … & Toan, N. L. (2018). Combination of vaccine-strain measles and mumps viruses enhances oncolytic activity against human solid malignancies. Cancer investigation, 36(2), 106-117.
A. Hogan, C., Caya, C., & Papenburg, J. (2018). Rapid and simple molecular tests for the detection of respiratory syncytial virus: a review. Expert review of molecular diagnostics, 18(7), 617-629.
