
Ahogy azt még a blog hajnalán írtam egyszer, a világ legősibb sejtvonala nem valamilyen sztárlabor inkubátorainak mélyén tenyészik Petri-csészékben, hanem hús-vér kutyák segítségével maradt fent, több ezer éven át.
A szóban forgó sejtvonal tulajdonképpen a kevés (ismert) ragályos rákok egyike, a kutyák ún. Sticker szarkómáját okozó CTVT (Canine Transmissible Venereal Tumor) – a többiek ebben a kategóriákban a Tasmán ördögök arctumorja, illetve a különböző kagylók leukémiája lennének.
A CTVT egy különleges, kvázi szexuális úton terjedő “betegség”, ami valamikor pár ezer éve jöhetett létre és azóta viszonylag szabadon terjed a világ ebei közt. A fertőzés egy elég enyhe lefutású betegséget okoz, amiből a kutyák többynire kigyógyulnak. A félreértések végett, bár az irodalom számos olyan vírust ismer, amelyek képesek daganatos betegségeket indukálni, itt nem arról van szó, ahol egy kórokozó (pl. vírus) adódik át az egyik egyedről a másikra, ahol aztán az új gazda sejtjeibe beépülve indukálja a betegséget, hanem a rákos sejtek maguk “metasztatizálnak” kvázi az új egyedbe, ahol daganatokat hoznak létre. Ennek megfelelően a CTVT genomja magában őrzi annak az ősi kutya egyednek az információját, ahol először jött ki úgy a lépés, hogy ez a látszólag korlátlan osztódásra késpes sejtvonal kialakulhatott.
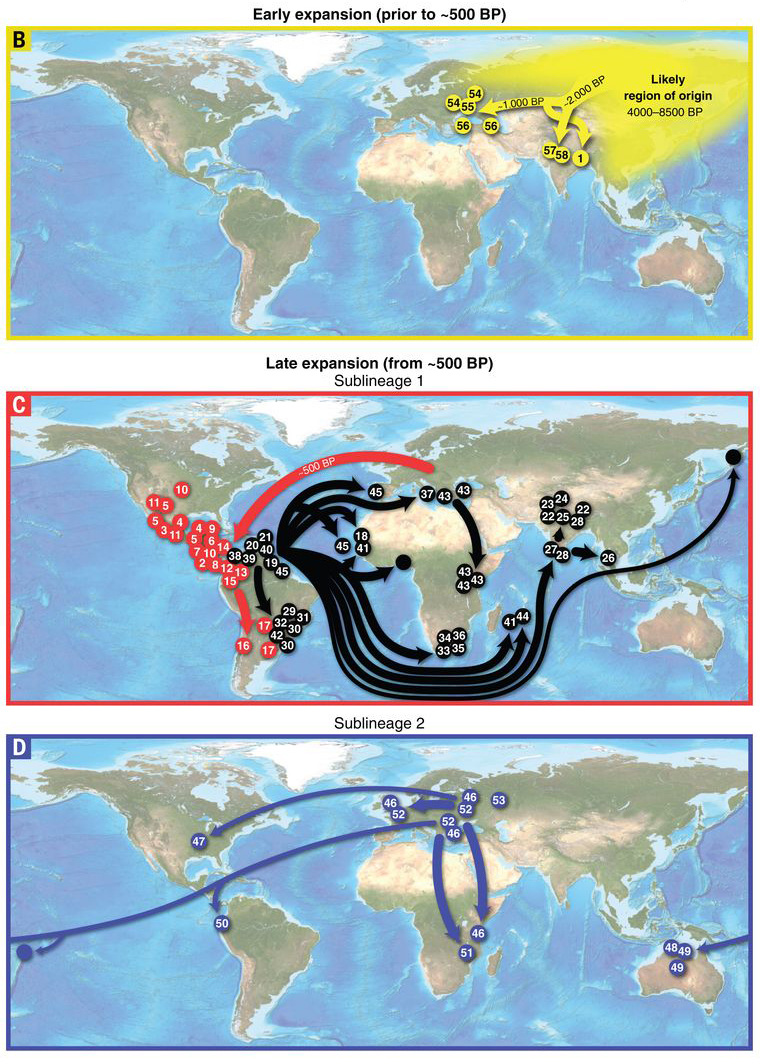
Amikor pár évvel ezelőtt az első CTVT tumor-genomot megszekvenálták, már sok érdekes dologra fény derült a kialakulásával kapcsolatban, de igazából csak a napokban megjelent Science tanulmány tudta alaposabban visszafejteni a CTVT történetét. Ehhez 546 darab, a világ összes tájáról begyűjtött különböző tumornak szekvenálták meg az exomját (vagyis nem a teljes genetikai anyagát, hanem kizárólag a fehérjekódoló részeket) és hasonlították össze azokat.
Mivel ez a tumor, kicsit absztraktan, egy kvázi aszexuálisan, klonálisan “terjeszkedő” élőlényként is felfogható, evolúciója is vizsgálható a modern molekuláris filogenetika eszköztárával. Az osztódó sejtek folyamatosan összeszednek új mutációkat, amelyeket mindig tovább adnak az utódsejtjeiknek. A különböző vonalak (és minden új gazdában lényegében egy új klón kialakulása történik meg) a maguk egyedi útján szedhetik össze ezeket a mutációkat, viszont az is nyilvánvaló, hogy két olyan CTVT sejtvonal, amelyben sok közös mutáció van, az nemrég válhatott csak szét. Ezzel a logikával dolgozva, a különböző CTVT mintákból felépíthető egy filogenetikai fa és annak alapján, hogy az egyes ágak milyen földrajzi területekhez köthetők rekonstruálható a CTVT története is.
Ha feltételezzük, hogy tudjuk, a mutációk kb. milyen ütemben jelennek meg, akkor még a kialakulás idejét is meg lehet saccolni – pontosabban egy intervallumot, mert nem biztos, hogy a CTVT sejtek mindig egyenletes ütemben szedtek össze új mutációkat. (Sőt, tk. szinte biztos, hogy nem így van és mondjuk az Egyenlítő környékén, ahol erősebb az UV sugárzás, megnő az UV-indukálta mutációk gyakorisága.)
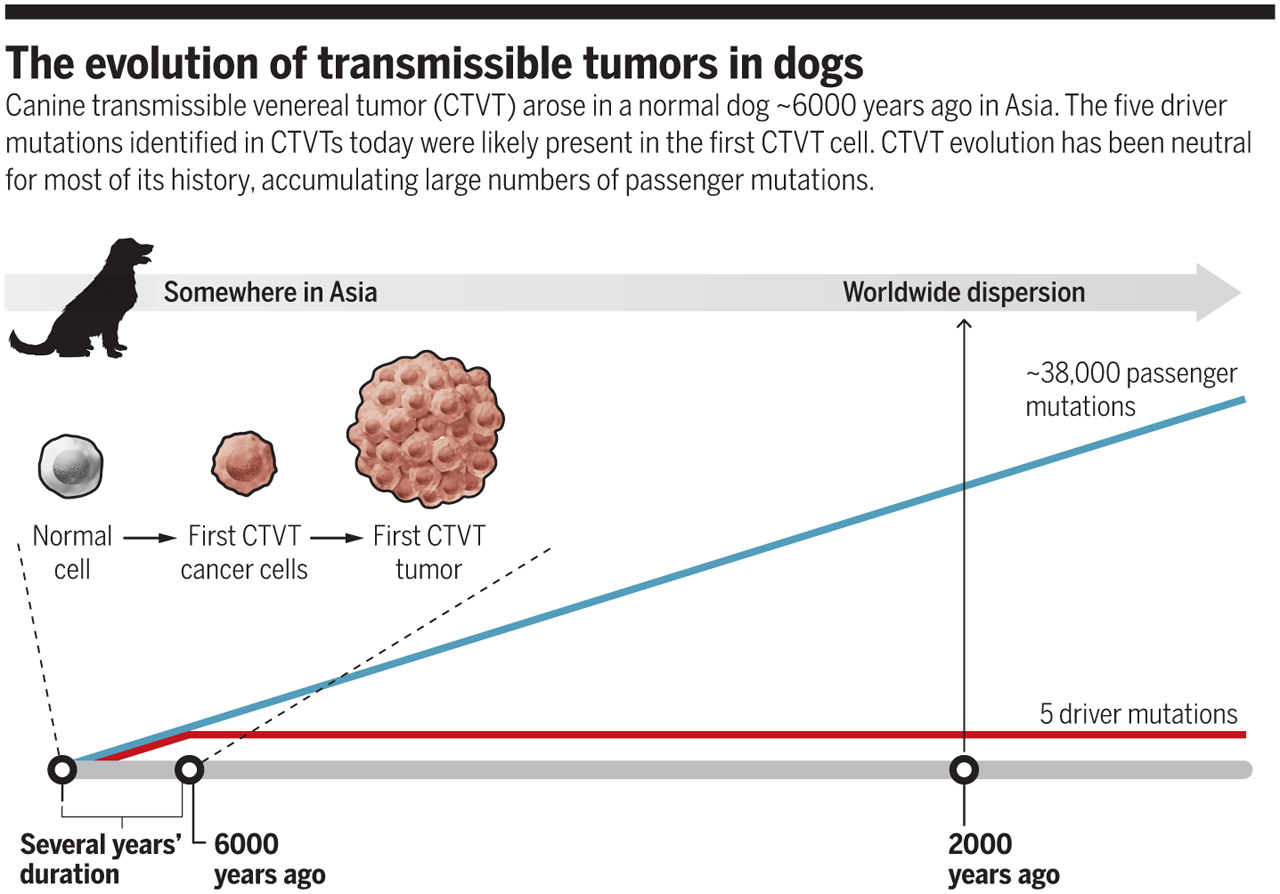
Ezek alapján úgy tűnik, hogy az a bizonyos kutya, amiben az első CTVT sejt megjelent, kb. 4000 – 8500 évvel ezelőtt élhetett Ázsiában. (Ugyan ez egy elég pontatlan meghatározásnak tűnhet, de már ez is sokat pontosít az eddig 2500-11 000 évben meghatározott intervallumon.) A tumor aztán sokáig csak lokálisan terjedt, mígnem durván kétezer évvel ezelőtt elindult világhódító útjára. Kb. i. sz. 1500 környékén már (elsősorban Kelet) Európában és az indiai szubkontinensen is jelen volt.
Később, nyilván nem függetlenül az európai gyarmatbirodalmak kiépülésétől, két főbb fejlődési szálat különíthetünk el a mutációs mintázatok alapján: egyrészt Amerika “meghódításával” párhuzamosan megjelenik az Újvilágban, ahonnan tova-terjed a rabszolgakereskedelem apropóján kialakuló kereskedelmi útvonalak mentén Afrikába és DK-Ázsiába (Sublineage 1). Egy másik szál közvetlenül Európából került át Afrikába, illetve Óceániába (Sublineage 2).
Persze a “történeti” szálon túl a CTVT biológiája is nagyon érdekes és itt is számos újdonságot árul el a tanulmány. Már korábban ismert volt, hogy az eredeti CTVT sejt feltehetőleg egy makrofág (falósejt), vagyis egy eleve mozgékony immunsejt-típus lehetett és mostanra az is látszik, hogy kb. 5 alapvető “driver” mutációt kellett ennek összeszednie ahhoz, hogy megszerezze az önállóság és az örök-élet kulcsát. Azaz ez az 5 alapvető mutáció elegendő ahhoz, hogy az emberi rákos sejtekhez hasonlóan gátlás nélkül tudjon osztódni és ideig-óráig a gazdaszervezet immunrendszere elől is el tudjon rejtőzni (utóbbira emberben azért nem ismerünk példát).
Ez a bűvös ötös szám, kb megegyezik azzal, amit az emberi tumoroknál is látunk (ti. ennyi kulcs-mutáció megjelenése után lesz egy sejt “rákos”), viszont ami igazából figyelemreméltó a CTVT esetén, hogy az évezredek során viszonylag stabil maradt. Bár folyamatos ütemben szedte össze az újabb és újabb mutációkat (mintánként 38,000 mutáció van a referencia kutyagenomhoz képest), úgy tűnik az alapvető működése nem sokat változott.
Pedig mostanra a teljes kutyagenom 20 000 fehérjekódoló génjéből csak kb. 2000 maradt működőképes – a többi szabadon (és a jelek alapján igazából tényleg random módon, minden szelekciós kényszer nélkü) szedte össze a funkcióvesztéses mutációkat. Nincs ebben semmi furcsa: egy teljes kutyát “felépíteni” sokkal több gént igényel, mint egy szabadon osztódó sejtvonalat fenntartani. Ugyanakkor, ez a maradék 2000 működő gén minden bizonnyal alapvető a CTVT fennmaradásához és mutációmentességük azt sugallja, hogy azok a klónok, ahol megjelentek az ezeket érintő mutációk nem voltak képesek fennmaradni.
És ez talán a CTVT egyik legérdekesebb tanulsága: egy viszonylag enyhe lefolyású betegséget okoz, ami nem érinti nagyon a gazdaszervezet fitensszét és így igazából nem indult el egy evolúciós “fegyverkezési verseny” sem a kutyák immunrendszere és a CTVT között. Ez lehet az oka a saját stabilitásának is: nagyon hamar elérhette a saját fitnessz-platóját, saját szempontjából nézve ideálisan működik és paradox módon, ellentétben számos, agresszív emberi rák logikájával, a legtöbb mutáció innen már érdemben nem növeli, ellenben akár jelentősen csökkentheti a fennmaradásának sikerét.
A cikk apropóján közölt kommentár is ezt emeli ki: ui. ez pont olyasmi, ami bizonyos, kevésbé agresszív emberi daganatok (pl. prosztata rák) esetében is hasznos stratégiának tűnik. Megtanulni menedzselni, kordában tartani a nem agresszív neopláziát. Ez, ha sikerül, sokkal eredményesebb lehet, mint azok a mai kemoterápiás eljárások, ahol a nem szelektíven alkalmazott beavatkozás elpusztítja a tumor nagy részét, de ezzel gyakran megágyaz a rezisztens, letális és gyorsan osztódó al-klónok terjedésének.
(A fedőkép forrása: Wikimedia.)
Maley CC, Shibata D (2019) Cancer cell evolution through the ages. Science 365(6452): 440-441. doi: 10.1126/science.aay2859.
Baez-Ortega A, Gori K, Strakova A, Allen JL, Allum KM, et al. (2019) Somatic evolution and global expansion of an ancient transmissible cancer lineage. Science 365(6452). pii: eaau9923. doi: 10.1126/science.aau9923.
