 Mivel őssejtekről már amúgy is régen esett szó: szóval az a nagy hír, hogy végre-valahára úgy tűnik, hogy (legalább részben) sikerült az ún. transzdifferenciálódás kérdést megoldani. A beavatatlanok számára röviden összefoglalva ez az a jelenség, amikor egy véglegesen differenciálódott sejtből (pl. bőrsejt) – vagy annak már jócskán differenciálódott elődjéből – egy teljesen más fajta sejtet állítunk elő, olyant ami egy másik csíralemezhez tartozik. Tehát, mivel a három csíralemezünk már a fejlődés legelején elkülönül, a transzdifferenciálódás során a célunk az, hogy egy képzeletbeli reset-gomb megnyomásával a sejttel elfelejtessük mibenlétét, és újraindítsuk benne a teljes fejlődési algoritmust. Magyarán azt várjuk el tőle, hogy kvázi ugyanúgy viselkedjen mint egy frissen megtermékenyült petesejt , vagy annak néhány osztódással későbbi utódja (bővebben itt volt még szó erről).
Mivel őssejtekről már amúgy is régen esett szó: szóval az a nagy hír, hogy végre-valahára úgy tűnik, hogy (legalább részben) sikerült az ún. transzdifferenciálódás kérdést megoldani. A beavatatlanok számára röviden összefoglalva ez az a jelenség, amikor egy véglegesen differenciálódott sejtből (pl. bőrsejt) – vagy annak már jócskán differenciálódott elődjéből – egy teljesen más fajta sejtet állítunk elő, olyant ami egy másik csíralemezhez tartozik. Tehát, mivel a három csíralemezünk már a fejlődés legelején elkülönül, a transzdifferenciálódás során a célunk az, hogy egy képzeletbeli reset-gomb megnyomásával a sejttel elfelejtessük mibenlétét, és újraindítsuk benne a teljes fejlődési algoritmust. Magyarán azt várjuk el tőle, hogy kvázi ugyanúgy viselkedjen mint egy frissen megtermékenyült petesejt , vagy annak néhány osztódással későbbi utódja (bővebben itt volt még szó erről).
Ez pedig nem triviális. Az elmúlt évek során már volt néhány hamis heuréka pillanat, amiről kiderült, hogy fasza kis mellékterméket találtak, így aztán ma már mindenki óvatosabb. Most azonban egy japán és egy amerikai csoport párhuzamosan nagyon hasonló eredményre jutott, hasonló elvet követve, ami akár bizakodásra is okot adhat.
A kutatók azt használták ki, hogy számos olyan gént ismerünk már, amelyek termékei nélkülözhetetlenek egy normális embrió fejlődése során az őssejtekben, s ha ezek hiányoznak, akkor a folyamat már pár sejtes állapotban elakad. Ezek a gének – Oct4, Sox2, c-Myc és Klf4 – a korai embrió elkötelezetlen (differenciálatlan) sejtjeiben még aktívak, de később kikapcsolódnak (ha esetleg mégsem, az gyakran tumorképződéshez vezet), amit a DNS reverzibilis ún. epigenetikai módosításával érnek el a szervezetek. Vagyis, ha őssejtet akarunk "előállítani", az ideális az lenne, ha ezeket a géneket közvetlenül be tudnánk kapcsolni (az epigenetikai módosítások törlésével). De ez sajna technikailag ma nem megvalósítható, így maradt B tervként az említett gének mesterséges bevitele retrovírus-vektorok révén, amivel valami hasonló hatást érünk el.
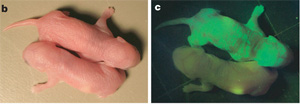
A két csoport egyaránt a sejttenyésztők egyik kis kedvencét, a fibroblaszt sejteket használta a kísérletekhez és azt figyelték, hogy az említett gének retrovirális bevitele után melyik sejtekben indul el a saját Oct4 gén kifejeződése, vagy egy másik őssejt marker, a Nanog expressziója (ezekhez a génekhez a zöld fluoreszcens fehérje szekvenciáját fűzték a sejtek genomjában, így átíródásuk könnyen észlelhető volt). Az ilyen (már nem is annyira) fibroblaszt sejtek morfológiailag nagyon hasonlónak tűntek a valódi embrionális őssejtekhez és a közelebbi vizsgálódás azt is kiderítette, hogy valóban átestek a resetelésen: a különböző gének kifejeződése és epigenetikai állapota egyaránt az "igazi" őssejtekre jellemző volt. Az igazi non-plusz-ultra kísérlet persze az, hogy a kiválogatott sejtek egy pár sejtes embrióba bejutva képesek-e mindenfajta sejttípust létrehozni? Képesek.
Az egyetlen gond az egész kísérlettel (ami miatt nem beszélhetünk máris potenciális klinikai alkalmazásokról) az paradox módon épp a kezdeti lépés, a négy gén retrovirális bevitele. Mert bár a "resetelt" sejtekben a gének így bevitt másolatai kikapcsolódtak (a genomon jelen levő "eredeti" változatok pedig be), sok esetben később kifejlett egerekben ez a kikapcsolódás elromlik. Az ilyen egerekben pedig durván megugrott a rákos megbetegedések száma. Emellett az is gond, hogy a retrovirális vektorok genomi integrálódását nem lehet irányítani, így mindig fennáll a veszélye, hogy rossz helyre kerülnek és valamilyen fontos másik gén működésébe zavarnak bele. De ennek ellenére ez egy fontos lépés afelé, hogy bármilyen sejtünkből, bármilyen másik sejtet csinélhassunk.
(Emlékeztetőül: erre elsősorban az etikai dilemmák miatt van szükség, mert a klasszikus őssejt-praktikák egy-egy embrió elpusztításával jártak, így pedig ez kikerülhető. Legalább is látszólag. Hiszen, ha egy fibroblaszt sejtet totipotenciális őssejtté transzdifferenciálunk, az majdhogynem egyenértékűvé válik egy megtermékenyített petesejttel. Vagyis az a kicsit skizofrén helyzet állhat elő, hogy az embrionális őssejtek pótolni akarva előbb klónozunk valakit, majd elpusztítjuk a klónját. Szerintem. Amennyiben tévedek, a kommentekben kéretik kijavítani.)
Okita K, Ichisaka T, Yamanaka S (2007) Generation of germline-competent induced pluripotent stem cells. Nature 448: 313-317.
Wernig M, Meissner A, Foreman R, Brambrink T, Ku M, Hochedlinger K, Bernstein BE, Jaenisch R (2007) In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 448: 318-324.

Nekem is pont ez a bajom a transzgenikus állatmodellekkel. Bármilyen vektorral is juttatnak be egy idegen (pl. humán) gént, örülnek, ha az nem lökődik ki, nem tudják még azt is kontrolálni, hogy hova is inzertálódik. Ergo lehet, hogy az így kapott fenotipus nem a bevitt gén miatt alakult ki, hanem az elrontott saját gén kiesése miatt. Sőt, tegyük hozzá, hogy a vizsgálandó bevitt génszakasz expressziós mintázata is egész más, mint az eredeti környezetében (pl. humánban). Plusz még a junk DNS sem annyira junk, mint eddig gondoltuk, tehát bárhová is épül be az idegen gén, jó eséllyel bezavar más gének működésébe-szabályzására.
Talán a mesterséges kromoszóma megoldhatja a problémát.
Adriaansen et al.: A novel approach for gene therapy: engraftment of fibroblasts containing the Artificial Chromosome Expression System at the site of inflammation. J Gene Med 2006; 8: 63–71.
Az utolso bekezdest nem ertem ? 🙂
Ami a vektorok integralodasi helyebol adodo aggalyokat illeti, ezek (remelhetoleg) hamarosan athidalhatoak lesznek un. docking site-ok alkalmazasaval (ld pl az alabbi url cimen). Ezek segitsegevel transzgenikus konstrukciok illeszthetoek majd egy jol karakterizalt helyre a gemomban. Sot, leteznek un. onmegsemmisito konsktrukciok is, ahol a transzgen mellett mondjuk Cre is expresszalodik, ami kivagja es egyuttal inaktivalja az egesz konstrukciot ugy ahogy van. Es ha jol ertem a cikket, akkor mar az endogen genek is aktivalodtak, tehat pusztan ez a kezdo lokes talan eleg lehet..
http://www.mshri.on.ca/nagy/projects.html
Igen, de azt, hogy a “docking-site” jo helyre kerult, azt szinten csak empirikusan tudjuk meg, ha jol ertem mi az eljaras lenyege. Ha mar van egy “jo” docking-site, akkor lehet jatszani – az adott sejtvonalban/torzsben. De mi van, ha mondjuk egy tok masik sejtvonalat/egertorzset akarok hasznalni?
Egyebkent a cikkek szerint az exogen myc demetilacioja volt a legnagyobb problema.